Мареев В.Ю. [1], Фомин И.В. [2], Агеев Ф.Т. [3], Арутюнов Г.П. [4], Беграмбекова Ю.Л. [1], Беленков Ю.Н. [5], Васюк Ю.А. [6], Галявич А.С. [7], Гарганеева А.А. [8], Гендлин Г.Е. [4], Гиляревский С.Р. [9], Глезер М.Г. [5], Драпкина О.М. [10], Дупляков Д.В. [11], Кобалава Ж.Д. [12], Козиолова Н.А. [13], Лопатин Ю.М. [14], Мареев Ю.В. [3], Моисеев В.С. [12], Недошивин А.О. [15], Перепеч Н.Б. [16], Ситникова М.Ю. [15], Скибицкий В.В. [17], Тарловская Е.И. [2], Чесникова А.И. [18], Шляхто Е.В. [15]
DOI: 10.18087/RHFJ.2017.1.2346
УДК 616.12–008.46–036.12 (083.13)
Ключевые слова: рекомендации, сердечная недостаточность, миокард, фракция выброса левого желудочка, функциональный класс сердечной недостаточности, острая декомпенсация сердечной недостаточности, ингибиторы АПФ, бета-адреноблокаторы, антагонисты минералкортикоидных рецепторов, диуретики, физические тренировки
Ссылка для цитирования: Мареев В.Ю., Фомин И.В., Агеев Ф.Т., Арутюнов Г.П., Беграмбекова Ю.Л., Беленков Ю.Н. и др. Клинические рекомендации. Хроническая сердечная недостаточность (ХСН). Журнал Сердечная Недостаточность. 2017;18 (1):3–40
Mareev V.Yu. [19], Fomin I.V. [20], Ageev F.T. [21], Arutyunov G.P. [22], Begrambekova Yu.L. [1], Belenkov Yu.N. [23], Vasyuk Yu.A. [24], Galyavich A.S. [25], Garganeeva A.A. [26], Gendlin G.E. [4], Gilyarevsky S.R. [27], Glezer M.G. [5], Drapkina O.M. [28], Duplyakov D.V. [29], Kobalava Zh.D. [30], Koziolova N.A. [31], Lopatin Yu.M. [32], Mareev Yu.V. [3], Moiseev V.S. [12], Nedoshivin A.O. [33], Perepech N.B. [34], Sitnikova M.Yu. [15], Skibitsky V.V. [35], Tarlovskaya E.I. [2], Chesnikova A.I. [36], Shlyakhto E.V. [15]
Clinical guidelines. Chronic heart failure (CHF)
Keywords: guidelines, heart failure, myocardium, left ventricular ejection fraction, functional class of heart failure, acute decompensated heart failure, ACE inhibitors, beta-adrenergic blocker agents, mineralocorticoid receptor antagonists, diuretics, physical exercises
For citation: Mareev V.Yu., Fomin I.V., Ageev F.T., Arutyunov G.P., Begrambekova Yu.L., Belenkov Yu.N. etal.
Clinical guidelines. Chronic heart failure (CHF). Russian Heart Failure Journal. 2017;18 (1):3–40
Краткая информация
Определение
Хроническая СН представляет собой заболевание с комплексом характерных симптомов (одышка, утомляемость и снижение физической активности, отеки и др.), которые связаны с неадекватной перфузией органов и тканей в покое или при нагрузке и часто с задержкой жидкости в организме. Первопричиной является ухудшение способности сердца к наполнению или опорожнению, обусловленное повреждением миокарда, а также дисбалансом вазоконстрикторных и вазодилатирующих нейрогуморальных систем.
Этиология и патогенез
Основными причинами развития ХСН в Российской Федерации являются АГ (95,5%), ИБС (69,7%) [1], перенесенный ИМ или ОКС (15,3%), СД (15,9%). Комбинация ИБС и АГ встречается у большинства больных ХСН [2]. Отмечается увеличение числа пациентов с пороками сердца (4,3%) с преобладанием дегенеративного порока аортального клапана. Менее распространенными причинами формирования ХСН являются перенесенные миокардиты (3,6%), кардиомиопатии [3], токсические поражения миокарда различной этиологии, в том числе ятрогенного генеза (химиотерапия, лучевые поражения миокарда и другое), анемии (12,3%) [4]. К числу частых причин ХСН также относятся ХОБЛ (13%), хроническая и пароксизмальная ФП (12,8%), перенесенное острое нарушение мозгового кровообращения (10,3%) [5].
ХСН – это патофизиологический синдром, при котором в результате того или иного заболевания сердечно-сосудистой системы или под влиянием других этиологических причин происходит нарушение способности сердца к наполнению или опорожнению, сопровождающееся дисбалансом нейрогуморальных систем (РААС, симпато-адреналовой системы, системы натрийуретических пептидов, кинин-калликреиновой системы) с развитием вазоконстрикции и задержкой жидкости, что приводит к дальнейшему нарушению функции сердца (ремоделированию) и других органов-мишеней (пролиферации), а также к несоответствию между обеспечением органов и тканей организма кровью и кислородом с их метаболическими потребностями.
Эпидемиология
Распространенность ХСН в различных регионах Российской Федерации варьирует в пределах 7–10% [6–11]. Доля пациентов с ХСН I–IV ФК увеличилась с 4,9% (1998 г.) до 8,8% (2014 г.) в репрезентативной выборке Европейской части Российской Федерации. Более значимо возросла доля пациентов с тяжелой (III–IV ФК) ХСН: с 1,2 до 4,1%. За 16 лет число пациентов с любым ФК ХСН увеличилось в 2 раза (с 7,18 до 14,92 млн.), а пациентов с тяжелой ХСН III–IV ФК – в 3,4 раза (с 1,76 до 6 млн. человек) [1]. Распространенность в репрезентативной выборке Российской Федерации ХСН IФК составляет 23%, IIФК – 47%, IIIФК – 25% и IVФК – 5% (госпитальный этап исследования ЭПОХА–ХСН) [12]. Больные ХСН стали достоверно старше: их средний возраст увеличился с 64,0±11,9 лет (1998г.) до 69,9±12,2 лет (2014г.). Более 65% больных ХСН находятся в возрастных группах старше 60 лет. Соотношение числа женщин, имеющих ХСН, к числу мужчин составляет примерно 3:1 [1, 6, 13, 14].
Кодирование по МКБ 10
Сердечная недостаточность (I50)
I50.0 – Застойная СН
I50.1 – Левожелудочковая недостаточность
I50.9 – Сердечная недостаточность неуточненная
Классификация
По ФВ ЛЖ:
По стадиям ХСН:
-
I стадия. Начальная стадия заболевания (поражения) сердца. Гемодинамика не нарушена. Скрытая СН. Бессимптомная дисфункция ЛЖ.
-
IIА стадия. Клинически выраженная стадия заболевания (поражения) сердца. Нарушения гемодинамики в одном из кругов кровообращения, выраженные умеренно. Адаптивное ремоделирование сердца и сосудов.
-
IIБ стадия. Тяжелая стадия заболевания (поражения) сердца. Выраженные изменения гемодинамики в обоих кругах кровообращения. Дезадаптивное ремоделирование сердца и сосудов.
-
III стадия. Конечная стадия поражения сердца. Выраженные изменения гемодинамики и тяжелые (необратимые) структурные изменения органов- мишеней (сердца, легких, сосудов, головного мозга, почек). Финальная стадия ремоделирования органов.
По ФК (см. таблица 1 (ШОКС), таблица 2 (6МТХ):
-
IФК. Ограничения физической активности отсутствуют: привычная физическая активность не сопровождается быстрой утомляемостью, появлением одышки или сердцебиения. Повышенную нагрузку больной переносит, но она может сопровождаться одышкой и/или замедленным восстановлением сил.
-
IIФК. Незначительное ограничение физической активности: в покое симптомы отсутствуют, привычная физическая активность сопровождается утомляемостью, одышкой или сердцебиением.
-
IIIФК. Заметное ограничение физической активности: в покое симптомы отсутствуют, физическая активность меньшей интенсивности по сравнению с привычными нагрузками сопровождается появлением симптомов.
-
IVФК. Невозможность выполнить какую‑либо физическую нагрузку без появления дискомфорта; симп томы СН присутствуют в покое и усиливаются при минимальной физической активности.
| Симптом/признак | Выраженность | Количество баллов |
|---|---|---|
Одышка |
0 - нет |
|
Изменился ли за последнюю неделю вес |
0 - нет |
|
Жалобы на перебои в работе сердца |
0 - нет |
|
В каком положении находится в постели |
0 - горизонтально |
|
Набухшие шейные вены |
0 - нет |
|
Хрипы в легких |
0 - нет |
|
Наличие ритма галопа |
0 - нет |
|
Печень |
0 - не увеличена |
|
Отеки |
0 - нет |
|
Уровень САД |
0 - более 120 мм рт. ст. |
|
Итого |
0 баллов – отсутствие клинических признаков СН.
I ФК – меньше или равно 3 баллам;
II ФК – от 4 до 6 баллов;
III ФК – от 7 до 9 баллов;
IV ФК – больше 9 баллов
| ФК | Расстояние, пройденное в течение 6 мин, м |
|---|---|
I |
426–550 |
II |
301–425 |
III |
151–300 |
IV |
<150 |
Примеры формулировки диагноза
Диагностика
Жалобы и анамнез
Типичными симптомами ХСН являются: одышка, слабость, повышенная утомляемость, сердцебиение, ортопноэ, отеки.
Менее типичными симптомами ХСН являются: ночной кашель, сердцебиение.
Специфичными признаками ХСН являются: набухание шейных вен, гепатоюгулярный рефлюкс, третий тон сердца (ритм галопа), смещение верхушечного толчка влево.
Менее специфичными признаками ХСН являются: периферические отеки (лодыжек, крестца, мошонки), застойные хрипы в легких, притупление в нижних отделах легких (плевральный выпот), тахикардия, нерегулярный пульс, тахипноэ (ЧДД >16 в мин), увеличение печени, асцит, кахексия, увеличение веса (>2кг/неделя).
Анамнез: выявляются этиологические причины и ФР, устанавливается время появления клинических симптомов и наличие эпизодов декомпенсации.
Физикальное обследование
Осмотр: бледность кожных покровов, акроцианоз, цианоз слизистых покровов, симметричная пастозность нижних конечностей (голень, лодыжки), симметричные отеки, анасарка, набухшие шейные вены (лежа, стоя).
Пальпация живота: печень выступает из‑под реберной дуги.
Перкуссия сердца и живота: увеличение границ относительной тупости сердца, увеличение размеров печени (по Курлову), нахождение свободной жидкости в брюшной полости.
Аускультация легких: хрипы в легких (симметричные от нижних отделов до всей поверхности легких), ослабление и отсутствие дыхательных шумов в нижних отделах легких.
Аускультация сердца: ослабление первого тона на верхушке, наличие ритма галопа, наличие шумов относительной недостаточности атрио-вентрикулярных клапанов.
Лабораторная диагностика
Общий анализ крови
Для исключения анемии и других причин, приводящих к одышке, назначается развернутый общий анализ крови (класс рекомендаций I, уровень доказанности C).
Биохимический анализ крови
Биохимический анализ крови: содержание натрия, калия, кальция, мочевины, печеночных ферментов, билирубина, ферритина и расчет общей железосвязывающей емкости крови, расчет СКФ на основании содержания креатинина в крови по формуле CKD-EPI, соотношения альбумин/креатинин в моче и оценка функции щитовидной железы. Перечисленные исследования показаны в следующих случаях: перед началом приема диуретиков, средств, подавляющих РААС, и антикоагулянтов для контроля их безопасности, для выявления устранимых причин СН (например, гипокальциемии и дисфункции щитовидной железы) и сопутствующих заболеваний (например, дефицита железа) для определения прогноза (класс рекомендаций I, уровень доказанности C).
Натрийуретические гормоны
Исследование содержания в крови натрийуретических гормонов (BNP и NTproBNP) показано для исключения альтернативной причины одышки и определения прогноза. Диагностически значимыми являются уровень BNP более 35пг/мл, уровень NT-proBNP – более 125 пг/мл [15–22] (класс рекомендаций IIa, уровень доказанности C).
Инструментальная диагностика
Электрокардиограмма (ЭКГ)
ЭКГ в 12‑ти отведениях рекомендована для определения ритма сердца, ЧСС, ширины и формы комплекса QRS, а также выявления иных важных нарушений. ЭКГ помогает определить дальнейший план лечения и оценить прогноз. Нормальная ЭКГ практически исключает наличие систолической СН (класс рекомендаций I, уровень доказанности C).
Трансторакальная ЭхоКГ
Трансторакальная ЭхоКГ рекомендована для оценки структуры, систолической и диастолической функции миокарда, в том числе у пациентов, находящихся на лечении, потенциально повреждающем миокард (например, химиотерапия), а также для выявления и оценки клапанной патологии, оценки прогноза (класс рекомендаций I, уровень доказанности C).
Дополнительные технологии (включая тканевую допплерографию, показатели деформации миокарда, в том числе Strain и Strain rate) могут включаться в протокол ЭхоКГ исследования у пациентов с риском развития СН для выявления дисфункции миокарда на доклинической стадии (класс рекомендаций IIa, уровень доказанности С).
Рентгенография грудной клетки
Рентгенография грудной клетки позволяет обнаружить кардиомегалию (кардиоторакальный индекс более 50%), венозный застой или отек легких (класс рекомендаций IIa, уровень доказанности C).
Магнитно-резонансная томография (МРТ)
МРТ сердца рекомендована для оценки структуры и функции миокарда (включая правые отделы) с плохим акустическим окном, а также у пациентов со сложной сочетанной врожденной патологией сердца (с учетом ограничений/противопоказанийкМРТ),атакжедляхарактеристики миокарда при подозрении на миокардит, амилоидоз, болезнь Чагаса, болезнь Фабри, некомпактный миокард, гемохроматоз (класс рекомендаций I, уровень доказанности С).
Коронарная ангиография
Коронарная ангиография рекомендована для оценки поражения коронарных артерий у больных со стенокардией напряжения, которым в дальнейшем может быть выполнена реваскуляризация миокарда (класс рекомендаций I, уровень доказанности C).
Катетеризация левых и правых отделов сердца рекомендована перед трансплантацией сердца или имплантацией устройства для длительного вспомогательного кровообращения с целью оценки функции левых и правых отделов сердца, а также легочного сосудистого сопротивления (класс рекомендаций I, уровень доказанности C).
Стресс-ЭхоКГ, ОФЭКТ, ПЭТ
Для оценки ишемии и жизнеспособности миокарда могут применяться: стресс-ЭхоКГ с физической или фармакологической нагрузкой [23], однофотонная эмиссионная компьютерная томография (ОФЭКТ) [24], позитронно-эмиссионная томография (ПЭТ) [25, 26] у пациентов с СН и ИБС для принятия решения о реваскуляризации (класс рекомендаций IIb, уровень доказанности B) [27–29].
Холтеровский мониторинг
ЭКГ Холтеровский мониторинг ЭКГ рутинно не применяется у больных ХСН и показан только при наличии симптомов, предположительно связанных с нарушениями ритма сердца и проводимости (например, при сердцебиении или обмороках). У больных с ФП при суточном мониторинге ЭКГ следят за частотой желудочковых сокращений (класс рекомендаций IIb, уровень доказанности С).
Пробы с физической нагрузкой под контролем ЭКГ
Пробы с физической нагрузкой под контролем ЭКГ позволяют получить объективную оценку переносимости физической нагрузки, а также выяснить наличие ишемии миокарда(классрекомендацийIIb,уровеньдоказанностиC).
Кардиопульмональное нагрузочное тестирование (КПНТ)
Тестирование помогает выяснить, с чем связана одышка – с патологией сердца или легких (класс рекомендаций IIa, уровень доказанности C). Также оно важно при рассмотрении вопроса о трансплантации или установке искусственного ЛЖ (класс рекомендаций I, уровень доказанности C) [30], для назначения физических тренировок (класс рекомендаций IIa, уровень доказанности C).
Иная диагностика
Тест 6‑минутный ходьбы (6МТХ)
Дистанция 6МТХ может быть использована для определения ФК ХСН и объема физических тренировок (класс рекомендаций IIa, уровень доказанности C).
Шкала оценки тяжести СН (ШОКС)
Шкала при сборе анамнеза и клиническом обследовании больного позволяет в динамике оценивать эффективность проводимого лечения ХСН (класс рекомендаций I, уровень доказанности B) [31].
Лечение
Консервативное лечение
Задачи лечения: предотвращение прогрессирования ХСН (при IФК), уменьшение симптомов, повышение качества жизни, торможение и обратное развитие ремоделирования органов-мишеней, уменьшение количества госпитализаций, снижение смертности.
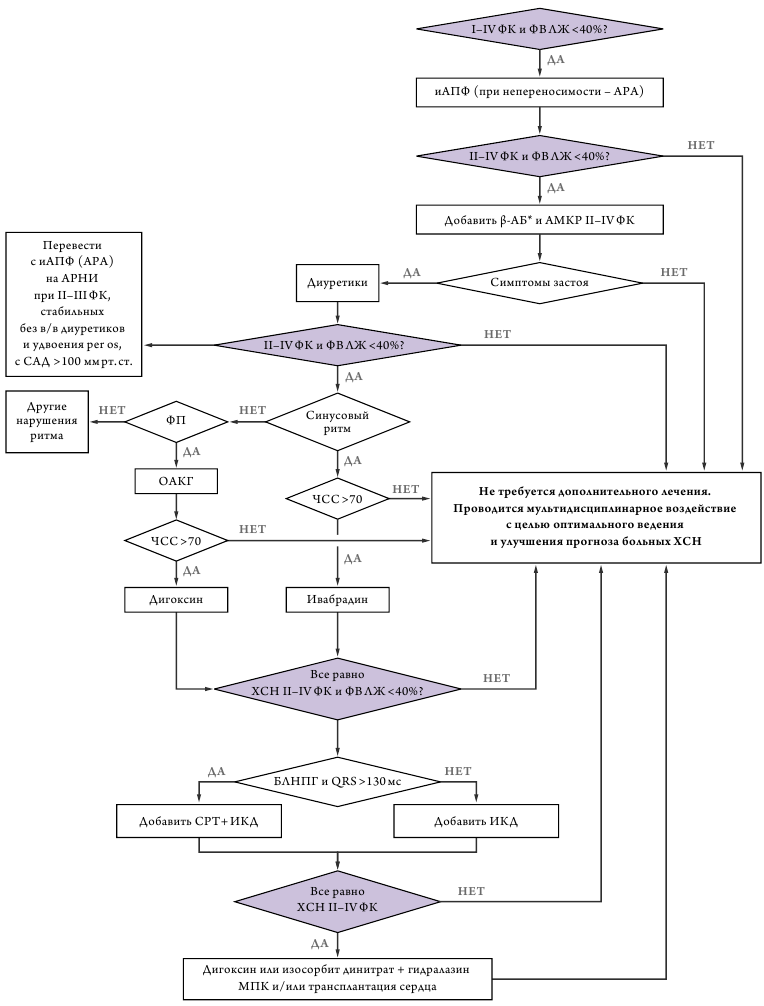
Алгоритм ведения пациентов с ХСН представлен на рис.1.
Все лекарственные средства для лечения ХСН и сниженной ФВ ЛЖ можно разделить на две основные категории соответственно степени доказанности (рис.2, табл.3).
Основные препараты, влияющие на прогноз больных ХСН
Ингибиторы ангиотензинпревращающего фермента (иАПФ)
Ингибиторы АПФ в максимально переносимых дозах применяются у всех больных ХСН I–IV ФК и с ФВЛЖ <40% для снижения риска смерти, повторных госпитализаций и улучшения клинического состояния. Отказ от назначения иАПФ больным с низкой и промежуточной ФВ ЛЖ не может считаться оправданным при уровне САД >85 мм рт.ст. и ведет к повышению риска смерти больных с ХСН (класс рекомендаций Ia уровень доказанности А). Ингибиторы АПФ пока не доказали своей способности улучшать прогноз пациентов с СНпФВ. Вместе с тем в связи с улучшением функционального статуса пациентов и уменьшением риска вынужденных госпитализаций иАПФ показаны всем пациентам с СНпФВ (класс рекомендаций IIa, уровень доказанности В). Режим дозирования иАПФ представлены в таблице 4.
Антагонисты рецепторов 1 типа АII (АРА)
АРА в максимально переносимых дозах применяются у больных ХСН I–IV ФК c ФВЛЖ<40% для снижения комбинации риска смерти и госпитализаций по поводу ХСН при непереносимости иАПФ (класс рекомендаций IIa, уровень доказанности A). АРА не доказали способности улучшать прогноз больных с СНсФВ и с СНпФВ. Применение АРА кандесартана у больных с СНсФВ и с СНпФВ может снизить частоту госпитализаций (класс рекомендаций IIb, уровень доказанности В), а при непереносимости иАПФ у таких больных кандесартан может быть препаратом выбора (класс рекомендаций IIa, уровень доказанности В). Режим дозирования (табл. 6).

| Препарат | Показание | Класс | Доказанность | |
|---|---|---|---|---|
Диуретики |
Применяются у всех больных ХСН II-IV ФК с ФВ ЛЖ <40 % с признаками застоя для улучшения клинической симптоматики и снижения риска повторных госпитализаций |
I |
C |
|
Дигоксин |
Применяется у всех больных ХСН II-IV класса с ФВ ЛЖ <40%, при ФП с целью урежения и упорядочения ритма, улучшения прогноза и снижения риска госпитализаций |
I |
C |
|
Дигоксин |
Назначение должно быть рассмотрено у больных ХСН с ФВ ЛЖ <40%, синусовым ритмом при недостаточной эффективности основных средств лечения декомпенсации для уменьшения риска повторных госпитализаций |
IIA |
B |
|
Ивабрадин |
Назначение должно быть рассмотрено у больных ХСН II-IV ФК с ФВ ЛЖ <40%, синусовым ритмом, ЧСС >70 уд/мин ПЛЮС к основной терапии (в том числе β-АБ) для снижения риска суммы смертей плюс госпитализаций из-за обострения ХСН |
IIA |
B |
|
Омега-3 ПНЖК (содержащие 90% этиловых эфиров длинноцепочечных Омега-3 полиненасыщенных жирных кислот (46% эйкозапентаеновой и 38% докозагексаеновой кислот в соотношении 1,2/1) |
Назначение должно быть рассмотрено у больных ХСН II-IV ФК с ФВ ЛЖ <35% для снижения риска смерти, в т.ч. внезапной, и повторных госпитализаций плюс к основным средствам лечения ХСН |
IIA |
B |
|
Низкомолекулярные гепарины |
Назначение должно быть рассмотрено у больных ХСН II-IV ФК с ФВ ЛЖ <40% при наличии венозного тромбоза или декомпенсации, требующей соблюдения постельного режима (≥3 дней) для снижения риска тромбоэмболий, улучшения прогноза и снижения риска госпитализаций |
IIA |
B |
|
ОАКГ |
Должны быть назначены больным ХСН II-IV ФК с ФВ ЛЖ <35% для снижения риска смерти и госпитализаций при ФП или внутрисердечном тромбозе (подробнее см. табл. 5) |
I |
IIA |
A |
| Препарат | Стартовая доза | Стартовая доза (при гипотонии) | Терапевтическая доза | Максимальная доза |
|---|---|---|---|---|
Эналаприл |
2,5 х 2 |
1,25 х 2 |
10 х 2 |
20 х 2 |
Каптоприл |
6,25 х 3 (2)* |
3,125 х 3 (2) |
25 х 3 (2) |
50 х 3 (2) |
Фозиноприл |
5х1 (2) |
2,5 х 1 (2) |
10-20 х 1 (2) |
20 х1 (2) |
Периндоприл |
2 х 1 |
1 х 1 |
4 х 1 |
8 х 1 |
Лизиноприл |
2,5 х 1 |
1,25 х 1 |
10 х 1 |
20 х 1 |
Рамиприл |
2,5 х 2 |
1,25 х 2 |
5 х 2 |
5 х 2 |
Спираприл |
3 х 1 |
1,5 х 1 |
3 х 1 |
6 х 1 |
Трандолаприл |
1 х 1 |
0,5 х 1 |
2 х 1 |
4 х 1 |
Хинаприл |
5х1 (2) |
2,5 х 1 (2) |
10-20 х 1 (2) |
40 х1 (2) |
Зофеноприл |
7,5 х 1 (2) |
3,75 х 1 (2) |
15х1 (2) |
30 х1 (2) |
* - цифры в скобках показывают возможность различной кратности назначения иАПФ при ХСН
| Препарат | Показание | Класс | Доказанность |
|---|---|---|---|
Варфарин при МНО* 2-3 |
Применение должно быть рассмотрено у больных ХСН I-IV ФК с ФВ ЛЖ <40% при синусовом ритме и наличии внутрисердечного тромба для предотвращения риска тромбоэмболий, улучшения прогноза и снижения риска повторных госпитализаций |
IIA |
C |
Варфарин при МНО* 2-3 |
Может применяться у больных с синусовым ритмом моложе 60 лет для предотвращения риска инсульта и других СС осложнений без увеличения риска кровотечений |
IIB |
C |
НОАК |
Не должны применяться у всех больных ХСН I-IV ФК с ФВ ЛЖ <40% при синусовом ритме без признаков внутрисердечного тромба, так как не снижают риск тромбоэмболий при увеличении кровотечений |
III |
B |
* - Международное нормализованное отношение (МНО)
Антагонисты рецепторов неприлизина (АРНИ)
АРНИ рекомендуются больным с ХСН II–III ФК с ФВ ЛЖ <40% стабильного течения (без декомпенсации, назначения в/в или удвоения дозы пероральных диуретиков и с САД >100 мм рт. ст.), при переносимости иАПФ (или АРА). Перевод данной категории больных на АРНИ (в дозе 100 мг x 2 раза в день не ранее, чем через 36 часов после последней дозы иАПФ (АРА) с последующей титрацией дозы до оптимальной 200 мг x 2 раза в день) производится для дополнительного снижения риска смерти и последующих госпитализаций в связи с ухудшением течения ХСН (класс рекомендаций I, уровень доказанности В). Можно рассмотреть применение АРНИ у больных с ХСН II–III ФК с ФВ ЛЖ <35% стабильного течения в качестве стартовой терапии (вместо иАПФ) для снижения риска смерти и госпитализаций в связи с ухудшением течения ХСН (класс рекомендаций IIa, уровень доказанности C). Комбинация двух блокаторов ренин-ангиотензиновой системы (исключая антагонисты минералокортикоидных рецепторов (АМКР) не рекомендуется для лечения больных ХСН в связи с существенным ростом серьезных нежелательных явлений, включающих симптомную гипотонию и ухудшение функции почек (класс рекомендаций III, уровень доказанности A).
β-адреноблокаторы (β-АБ)
Бета-АБ применяются у всех больных ХСН II–IV ФК и ФВ ЛЖ <40% для снижения риска смерти и повторных госпитализаций вместе с иАПФ (АРА) и АМКР (класс рекомендаций I, уровень доказанности A). β-АБ назначаются, начиная с 1/8 средней терапевтической дозы, оптимально после достижения состояния компенсации, и медленно титруются до максимально переносимой (табл.7–8).
| Препарат | Стартовая доза | Стартовая доза (при гипотонии) | Терапевтическая доза | Максимальная доза |
|---|---|---|---|---|
Кандесартан |
4 мг х 1 р/д |
2 мг х 1 р/д |
1 6 мг х 1 р /д |
32 мг х 1 р/д |
Валсартан |
40 мг х 2 р/д |
20 мг х 2 р/д |
80 мг х 2 р/д |
160 мгх 2 р/д |
Лозартан |
50 мг х 1 р/д |
25 мг х 1 р/д |
100 мг х 1 р/д |
150 мг х 1 р /д |
| Препарат | Стартовая доза | Терапевтическая доза | Максимальная доза |
|---|---|---|---|
Бисопролол |
1,25 мг х 1 |
10 мг х 1 |
10 мг х 1 |
Метопролол сукцинат замедленного высвобождения |
12,5 мг х 1 |
100 мг х 1 |
200 мг х 1 |
Карведилол |
3,125 мг х 2 |
25 мг х 2 |
25 мг х 2 |
Небиволол* |
1,25 мг х 1 |
10 мг х 1 |
10 мг х 1 |
* – у больных старше 70 лет
Уже назначенные β-АБ |
Рекомендованные β-АБ (стартовая доза) |
||
Бисопролол |
Метопролола сукцинат замедленного высвобождения |
Карведилол |
|
Атенолол <25 мг/сут |
1,25 мг |
12,5 мг |
3,125 мг х 2 р/д |
Атенолол 25-75 мг/сут |
2,5 мг |
25 мг |
6,25 мг х 2 р/д |
Атенолол >75 мг/сут |
5 мг |
50 мг |
12,5 мгх 2 р/д |
Метопролола тартрат <25 мг/сут |
1,25 мг |
12,5 мг |
3,125 мг х 2 р/д |
Метопролола тартрат 25-75 мг/сут |
2,5 мг |
25 мг |
6,25 мг х 2 р/д |
Метопролола тартрат >75 мг/сут |
5 мг |
50 мг |
12,5 мг х 2 р/д |
β-АБ могут быть назначены больным СНпФВ и СНсФВ с целью уменьшения ЧСС и выраженности гипертрофии левого желудочка. Помимо снижения ЧСС, α-β-АБ карведилол оказывает положительное влияние на показатели релаксации ЛЖ у пациентов с СНсФВ [32, 33] (класс рекомендаций IIb, уровень доказанности С). Дополнительный анализ исследования SENIORS продемонстрировал способность небиволола снижать риск госпитализаций и смерти больных с СНпФВ (класс рекомендаций IIa, уровень доказанности C).
Ивабрадин применяется у больных ХСН II–IV ФК и ФВЛЖ<40% c синусовым ритмом и ЧСС >70 уд/мин при непереносимости β-АБ для снижения риска смерти и госпитализаций (класс рекомендаций IIa, уровень доказанности С).
Антагонисты минералокортикоидных рецепторов (АМКР)
АМКР в дозах 25–50 мг/сут применяются у всех больных ХСН II–IVФК и ФВЛЖ <40% для снижения риска смерти, повторных госпитализаций и улучшения клинического состояния вместе с иАПФ (АРА) и β-АБ (класс рекомендаций I, уровень доказанности A). Антагонисты МКР могут быть назначены пациентам с СНсФВ и с СНпФВ для снижения числа госпитализаций по поводу ХСН (класс рекомендаций IIa, уровень доказанности B).
Таким образом, тройная нейрогормональная блокада – иАПФ (при непереносимости АРА) или АРНИ (при стабильной ХСН с САД>100 мм рт.ст.) в сочетании с β-АБ и АМКР является основой терапии СНнФВ и суммарно на 45% снижает смертность пациентов с ХСН I–IVФК [34].
Препараты, влияющие на прогноз больных ХСН и применяемые в определенных клинических ситуациях
Диуретики
Диуретики применяются у всех больных ХСН II–IV ФК с ФВЛЖ<40% и признаками застоя для улучшения клинической симптоматики и снижения риска повторных госпитализаций (класс рекомендаций I, уровень доказанности C). Диуретики могут быть назначены в случае задержки жидкости в организме у пациентов с СНсФВ/СНпФВ, но их следует использовать с осторожностью, чтобы не вызвать чрезмерного снижения преднагрузки на ЛЖ и падение сердечного выброса (класс рекомендаций IIb, уровень доказанности С).
Дегитратационная терапия в активной фазе (при наличии застойных явлений) проводится с превышением выделенной мочи над выпитой жидкостью не более 1–1,5 литра в сутки во избежание электролитных, гормональных, аритмических и тромботических осложнений. Комбинируются петлевые диуретики торасемид или фуросемид с диуретической дозой АМКР (100–300 мг/сут). Торасемид имеет преимущества над фуросемидом по силе действия, степени всасываемости (удобство приема внутрь), длительности действия (лучше переносимость, при меньшей частоте мочеиспусканий), положительному влиянию на нейрогормоны (меньше электролитных нарушений, уменьшение прогрессирования фиброза миокарда и улучшение диастолического наполнения сердца) и достоверно снижает риск повторных госпитализаций в связи с обострением ХСН (класс рекомендаций IIa, уровень доказанности B).
После достижения эуволемии диуретики назначаются ежедневно в минимальных дозах, позволяющих поддерживать сбалансированный диурез (торасемид или фуросемид). Для поддержания оптимального кислотно-основного состояния, сохранения чувствительности к петлевым диуретикам и нормализации почечного кровотока раз в 2 недели рекомендуются 4–5-дневные курсы ИКАГ ацетозоламида (0,75/сут) (класс рекомендаций I, уровень доказанности С). При тяжелых полостных и рефрактерных отеках возможна дополнительная механическая эвакуация жидкости из полостей (пара-, плевро- или перикардиоцентез) или изолированная ультрафильтрация (класс рекомендаций IIb, уровень доказанности C).
Ивабрадин
При недостижении ЧСС 70 уд/мин ивабрадин добавляется к основной терапии (в том числе к β-АБ) для снижения риска смерти и повторных госпитализаций (класс рекомендаций IIa, уровень доказанности B).
Дигоксин
Дигоксин назначается пациентам с ХСН с ФВ ЛЖ <40% и синусовым ритмом при недостаточной эффективности основных средств лечения декомпенсации для уменьшения риска повторных госпитализаций (класс рекомендаций IIa, уровень доказанности B).
Назначение дигоксина производится при контроле уровня препарата в крови (при концентрации более 1,1–1,2 нг/мл необходимо уменьшение дозировки) как при синусовом ритме, так и при ФП (оптимальные значения концентрации дигоксина в крови <0,9 нг/мл) при отсутствии противопоказаний (класс рекомендаций I, уровень доказанности C) [35]. При невозможности определения концентрации дигоксина прием препарата может быть продолжен в малых дозах (0,25–0,125 мкг) в случае, если нет данных о гликозидной интоксикации (при массе тела <60 кг, особенно у женщин, в возрасте >75 лет и при СКФ <60 мл / мин/1,73 м2 , не более 0,125 мг) (класс рекомендаций I, уровень доказанности C). У больных, ранее не принимавших дигоксин, его назначение должно быть рассмотрено при тахисистолической форме ФП (класс рекомендаций IIa, уровень доказанности C) и при синусовом ритме в случае наличия нескольких эпизодов ОДСН в течение года, низкой ФВ ЛЖ ≤25%, дилатации ЛЖ и высокого ФК (III–IV) вне эпизода ОДСН (класс рекомендаций IIa, уровень доказанности B) [36].
Омега-3 полиненасыщенные жирные кислоты (Омега-3 ПНЖК)
Назначение Омега-3 ПНЖК в форме Омега-3 полиненасыщенных жирных кислот, содержащих 90% этиловых эфиров длинноцепочечных омега-3 полиненасыщенных жирных кислот (46% эйкозапентаеновой и 38% докозагексаеновой кислот в соотношении 1,2/1) должно быть рассмотрено у пациентов с ХСН II–IV ФК и ФВ ЛЖ <40% для снижения риска смерти, в т.ч. внезапной, и повторных госпитализаций в дополнение к основным средствам лечения ХСН (класс рекомендаций IIa, уровень доказанности B).
Оральные антикоагулянты (ОАКГ)
ОАКГ должны быть назначены больным ХСН II–IV ФК для снижения риска смерти и госпитализаций при ФП (класс рекомендаций I, уровень доказанности A) или внутрисердечном тромбозе (класс рекомендаций IIa, уровень доказанности A). ОАКГ не должны применяться у всех больных ХСН I–IV ФК при синусовом ритме без признаков внутрисердечного тромба, так как они не снижают риск тромбоэмболий при увеличении риска кровотечений (класс рекомендаций III, уровень доказанности B).
Для больных с ХСН и неклапанной ФП, которым показана (количество баллов по CHA2DS2VASc >2) антикоагулянтная терапия следует предпочесть назначение новых оральных антикоагулянтов (НОАК) вместо антагонистов витамина К (АВК), учитывая бóльшее снижение риска смерти и тромбоэмболических осложнений при одновременном снижении риска кровотечений, прежде всего внутричерепных (класс рекомендаций IIa, уровень доказанности B). Применение НОАК противопоказано при наличии механических клапанов и митральном стенозе с наложениями на клапанах (класс рекомендаций III, уровень доказанности B). Вне зависимости от риска тромбоэмболий НОАК не должны применяться у пациентов с ФП и СКФ <30 мл/мин/1,73 м2 (класс рекомендаций III, уровень доказанности A).
Гепарин
Назначение гепарина или низкомолекулярных гепаринов (НМГ) на срок, как минимум, 7 дней должно быть рассмотрено у больных ХСН II–IV ФК с ФВ ЛЖ <40% при наличии венозного тромбоза, ТЭЛА или декомпенсации, требующей соблюдения постельного режима (≥3 дней), для снижения риска тромбоэмболий, улучшения прогноза и снижения риска госпитализаций (класс рекомендаций I, уровень доказанности C) с последующим переводом на АВК (с контролем МНО) или ОАКГ (класс рекомендаций I, уровень доказанности B).
При наличии венозного тромбоза и ТЭЛА у больных ХСН возможна альтернативная терапия ингибиторами Ха-фактора вместо гепарина с переводом на НОАК: апиксабан 10 мг x 2 раза в день в течение 7 дней с последующим переводом на 5 мг x 2 раза в день (класс рекомендаций I, уровень доказанности В) или ривароксабан 15 мг x 2 раза в день в течение 21 дня с переводом на 20 мг x 1 раз в день (класс рекомендаций I, уровень доказанности В).
Длительность антикоагулянтой терапии при первом эпизоде венозного тромбоза или ТЭЛА составляет до 3-х месяцев (класс рекомендаций I, уровень доказанности А), а при повторных эпизодах должна быть более продолжительна (класс рекомендаций I, уровень доказанности В), в этих случаях следует предпочесть НОАК (класс рекомендаций IIa, уровень доказанности В), а при невозможности антикоагуляной терапии можно назначить аспирин (класс рекомендаций IIb, уровень доказанности В).
Препараты, не влияющие на прогноз больных ХСН и используемые для улучшения симптоматики
Антиаритмики
Антиаритмики (амиодарон, соталол) не влияют на прогноз больных с ХСН и могут применяться лишь для устранения симптомных желудочковых нарушений ритма сердца (класс рекомендаций IIb, уровень доказанности B).
Блокаторы медленных кальциевых каналов (БМКК)
Дигидропиридиновые БМКК (амлодипин и фелодипин) не влияют на прогноз больных ХСН [37, 38].
Эти препараты могут быть назначены на фоне основной терапии ХСН для дополнительного контроля АД, давления в легочной артерии и клапанной регургитации (класс рекомендаций IIb, уровень доказанности B).
Недигидропиридиновые БМКК верапамил и дилтиазем противопоказаны пациентам с СНпФВ и СНнФВ (класс рекомендаций III, уровень доказанности C).
Назначение верапамила и дилтиазема пациентам с СНсФВ для снижения ЧСС может быть рекомендовано только в случае непереносимости β-АБ и при отсутствии выраженной ХСН, проявляющейся, например, задержкой жидкости и ФВ ЛЖ >50% (класс рекомендаций IIb, уровень доказанности С).
Препараты железа
Внутривенное применение трехвалентных препаратов железа должно быть рассмотрено у больных ХСН с уровнем гемоглобина <120 г/л для уменьшения симптомов и улучшения толерантности к физическим нагрузкам (класс рекомендаций IIa, уровень доказанности A) [39, 40].
Ингибиторы ГМГ-КоА-редуктазы (статины)
Применение статинов не доказало влияния на прогноз больных ХСН, но приводило к уменьшению числа госпитализаций при ишемической этологии [41]. Первичное назначение статинов может быть рассмотрено у больных с ХСН ишемической этиологии (класс рекомендаций IIb, уровень доказанности A). Первичное назначение статинов больным с ХСН неишемической этиологии не рекомендуется (класс рекомендаций III, уровень доказанности B). Назначенная ранее терапия статинами больным с ишемической этиологией ХСН должна быть продолжена (класс рекомендаций IIa, уровень доказанности B).
Аспирин
Назначение аспирина не влияет на прогноз больных ХСН и в некоторых случаях ослабляет действие основных средств лечения [41–43]. Поэтому назначение аспирина может быть рассмотрено лишь у пациентов, перенесших ОКС не более 8 недель назад и подвергнутых процедурам чрескожного внутрисосудистого воздействия (класс рекомендаций IIb, уровень доказанности B).
Цитопротекторы (триметазидин МВ)
Назначение триметазидина МВ должно быть рассмотрено у больных с ХСН ишемической этиологии в дополнение к основным средствам лечения декомпенсации для устранения симптомов, нормализации гемодинамики (и увеличения ФВ ЛЖ) и возможного снижения риска смерти и повторных госпитализаций (класс рекомендаций IIA, уровень доказанности А). Доказательств положительного влияния на симптомы и прогноз других цитопротекторов в настоящее время нет.
Периферические вазодилататоры
Убедительных данных о влиянии вазодилататоров (в том числе нитратов и их комбинации с гидралазином) нет, и их применение может быть рассмотрено лишь для устранения стенокардии при неэффективности других методов (класс рекомендаций IIb, уровень доказанности B).
Коэнзим Q10
Применение коэнзима Q10 в дополнение к основным средствам лечения ХСН может приводить к росту ФВ ЛЖ и устранению симптомов [43, 44] и даже, как показано в относительно небольшом по объему рандомизированном клиническом исследовании, уменьшать смертность [45]. Поэтому применение коэнзима Q10 может быть рассмотрено в качестве дополнения к основной терапии ХСН (класс рекомендаций IIb, уровень доказанности B).
Хирургическое лечение
Стенокардия
При наличии стенокардии (класс рекомендаций I, уровень доказанности A) [46–48] или многососудистого поражения у больных ХСН с низкой ФВ ЛЖ при неэффективности ОМТ может быть рассмотрена коронарная реваскуляризация (класс рекомендаций IIb, уровень доказанности B) [49].
Клапанные пороки сердца
Возможны ситуации, когда существуют трудно распознаваемые пороки клапанов сердца, приводящие к СН или увеличивающие ее тяжесть. Больные с ХСН и поражением клапана (клапанов) сердца являются группой высокого риска [50].
В такой ситуации решение принимается консилиумом при тщательной оценке отношения риска/пользы с участием специалистов в области лечения пороков клапанов сердца: кардиолога – специалиста в области ХСН, кардиохирурга, специалиста по транскатетерной имплантации искусственных клапанов, специалиста в области визуализационных методов, анестезиолога, и если необходимо – геронтолога и реаниматолога. Особенно важно выявлять больных, которым может помочь транскатетерная имплантация аортального клапана (ТИАК) или транскатетерное вмешательство на митральном клапане.
Больные с низкой ФВ ЛЖ с измененными клапанами должны получать ОМТ ХСН (класс рекомендаций I, уровень доказанности C), однако необходимо помнить, что у больных с гемодинамически значимым стенозом аортального клапана вазодилататоры (иАПФ, АРА, БМКК, нитраты) могут вызвать артериальную гипотонию и должны применяться с осторожностью.
Больные со стенозом аортального клапана и ХСН
Если средний перепад давления (градиент) на аортальном клапане у такого пациента превышает 40 мм рт. ст., при наличии симптомов его следует оперировать при любой ФВ ЛЖ сердца, как бы она ни была снижена (класс рекомендаций I, уровень доказанности B). Больным с тяжелым аортальным стенозом и тяжелой ХСН, которые не смогут перенести операцию на открытом сердце, рекомендуется ТИАК (класс рекомендаций I, уровень доказанности B). Консилиум должен определить шанс по крайней мере годичной выживаемости после этой процедуры. Возможность применения ТИАК также должна быть рассмотрена консилиумом у больных с тяжелым изолированным стенозом аортального клапана, которые могли быть прооперированы на открытом сердце, однако риск этой операции чрезвычайно высок (класс рекомендаций IIa, уровень доказанности A).
Крайне важно определить, является ли именно аортальный стеноз причиной СН или кальцификация клапана возникла на фоне имеющейся ХСН. В последнем случае коррекция порока не принесет облегчения пациенту. Трудности такого определения связаны с тем, что у части пациентов с низкой систолической функцией ЛЖ средний градиент давления на аортальном клапане не превышает 40 мм рт. ст. Такой перепад давления может объясняться тем, что у больного имеется умеренный аортальный стеноз. При тяжелом аортальном стенозе градиент давления на клапане не создается из-за низкой систолической функции ЛЖ («low-flow, low-gradient»).
В таком случае предлагается проводить пробу с добутамином: если при введении добутамина ударный объем повышается и площадь клапана, рассчитанная с помощью допплеровских методик, увеличивается более чем на 0,2 см2, и при этом не повышается градиент, то речь идет об умеренном стенозе; напротив, при тяжелом аортальном стенозе с введением препарата и увеличением ударного объема площадь клапана не изменяется, но возрастает перепад давления на клапане (класс рекомендаций II, уровень доказанности C). В последнем случае обычно ожидаются хорошие результаты кардиохирургического лечения. Если в ответ на введение добутамина ударный объем не повышается более чем на 20%, у больного отсутствует резерв сократимости и прогноз расценивается как плохой независимо от лечения [51].
Больные с хронической аортальной регургитацией
Больным с тяжелой аортальной регургитацией при наличии симптомов показано кардиохирургическое лечение (чаще замена клапана на искусственный, реже возможны клапан-сохраняющие операции), а при бессимптомном течении следует проводить операцию только при ФВ ЛЖ ≤50% в состоянии покоя (класс рекомендаций I, уровень доказанности С).
Больные с хронической митральной регургитацией
Первичная (органическая) митральнаярегургитация (недостаточность)
Больным с тяжелой симптоматической органической митральной регургитацией показано кардиохирургическое лечение при отсутствии противопоказаний (класс рекомендаций I, уровень доказанности С). Решение о протезировании клапана или его реконструкции зависит от анатомии пораженного клапанного аппарата, подготовленности кардиохирурга, состояния больного. Надежная кардиохирургическая реконструкция клапана, проведенная у больного с низкой ФВ ЛЖ сердца (менее 30%), может улучшить его состояние, хотя ее влияние на продолжительность жизни неизвестно. В этом случае при выборе лечебной тактики учитывается ответ пациента на ОМТ, его коморбидность и возможность клапан-сохраняющей операции, а не протезирования.
Вторичная митральная регургитация (недостаточность)
Вторичная митральная регургитация возникает из-за расширения ЛЖ, а его ремоделирование приводит к неспособности створок митрального клапана полноценно закрываться. Эффективная медикаментозная и ресинхронизирующая терапия (при наличии показаний) приводят к обратному ремоделированию ЛЖ и уменьшению степени митральной регургитации, поэтому должны быть предприняты все усилия для оптимизации консервативной терапии таких больных.
Комбинированная кардиохирургическая коррекция митрального клапана и реваскуляризация могут быть произведены у пациентов с ХСН с низкой ФВ ЛЖ (<30%) и подходящей анатомией коронарных сосудов при наличии жизнеспособного миокарда ЛЖ (класс рекомендаций IIa, уровень доказанности C).
Хирургическая коррекция тяжелой митральной регургитации может быть рекомендована больным с низкой систолической функцией ЛЖ в процессе аорто-коронарного шунтирования (АКШ) (класс рекомендаций IIa, уровень доказанности С). Однако к настоящему времени не удалось доказать, что коррекция умеренной вторичной митральной регургитации во время АКШ улучшает обратное ремоделирование ЛЖ. Также не удалось показать преимуществ клапансохраняющих операций перед протезированием. При ФП желательно перед операцией на митральном клапане провести аблацию и закрытие ушка левого предсердия (класс рекомендаций IIa, уровень доказанности C).
Эффективность изолированной хирургической коррекции функциональной митральной регургитации при тяжелой систолической дисфункции (ФВ ЛЖ <30%) у больных, у которых невозможна реваскуляризация миокарда или имеется неишемический генез ХСН, пока не установлена. Такие больные должны получать ОМТ. В отдельных случаях реконструктивная операция на митральном клапане может быть произведена для того, чтобы избежать или отложить трансплантацию сердца (класс рекомендаций IIb, уровень доказанности С). Решение в таких случаях принимает консилиум после применения высокотехнологичных методов обследования больного (исследования глобальной продольной деформации ЛЖ, магнитно-резонансной томографии сердца и т.д.). У неоперабельных больных с ХСН или высоким операционным риском и умеренной или тяжелой вторичной митральной недостаточностью может быть принято решение о чрескожном вмешательстве на митральном клапане (чрескожная реконструкция конец-в-конец), хотя рандомизированных исследований, доказывающих улучшение качества жизни после этих процедур у больных с ХСН, нет (класс рекомендаций IIb, уровень доказанности C).
Трикуспидальная регургитация (недостаточность)
Вторичная (функциональная) трехстворчатая недостаточность часто осложняет естественное течение ХСН вследствие дилатации фиброзного кольца трехстворчатого клапана и повышенного тетеринга створок трикуспидального клапана в условиях перегрузки ПЖ сердца давлением и/или объемом. Тяжелая трехстворчатая регургитация приводит к появлению или к утяжелению симптомов и признаков правожелудочковой недостаточности, к необходимости применения больших доз мочегонных. В таких случаях застой в печени приводит к еще большему гиперальдостеронизму, и только добавление АМКР в диуретических дозах может уменьшить застой в большом круге.
Показания к хирургической коррекции вторичной трехстворчатой (трикуспидальной) недостаточности при ХСН четко не установлены. Возможность коррекции трехстворчатого клапана обычно возникает во время кардиохирургических операций на клапанах левых отделов сердца. Недавно показана возможность транскатетерного вмешательства на трехстворчатом клапане при его недостаточности [52].
Искусственный ЛЖ
Постановка искусственного ЛЖ должна быть рассмотрена у пациентов с терминальной СНнФВ ЛЖ (при оптимальной медикаментозной и немедикаментозной терапии) в качестве «моста к трансплантации» для улучшения симптоматики, снижения риска госпитализации и внезапной смерти у пациентов с показаниями к пересадке сердца (класс рекомендаций IIa, уровень доказанности С).
Постановка искусственного ЛЖ должна быть рассмотрена у пациентов с терминальной СНнФВ ЛЖ, сохраняющейся несмотря на оптимальную медикаментозную и немедикаментозную терапию, у пациентов, которые не являются кандидатами для трансплантации сердца (класс рекомендаций IIa, уровень доказанности B) [53–55].
Электрофизиологические методы
Применение всех электрофизиологических методов лечения ХСН должно начинаться только на фоне ОМТ при ее недостаточной эффективности. Это не альтернатива, а дополнение к максимально активной терапии больных. Имплантация устройств СРТ и ИКД рекомендуется больным, которые имеют продолжительность жизни не менее одного года после имплантации устройства.
Сердечная ресинхронизирующая терапия (СРТ) Имплантация СРТ/СРТ-Д показана пациентам с синусовым ритмом, имеющим СН-нФВ II–IV ФК с ФВ ЛЖ≤35%, блокаду левой ножки пучка Гисса (БЛНПГ) при длительности комплекса QRS ≥150 мс с целью улучшения клинического течения СН и уменьшения смертности (класс рекомендаций I, уровень доказанности A) [56–58].
Имплантация СРТ/СРТ-Д показана пациентам с сину совым ритмом, имеющим СНнФВ II–IV ФК с ФВЛЖ ≤35%, БЛНПГ при длительности комплекса QRS 130–149 мс, с целью улучшения клинического течения заболевания и уменьшения смертности (класс рекомендаций I, уровень доказанности B) [56–58].
Имплантация СРТ/СРТ-Д может быть рассмотрена у пациентов с СНнФВ, имеющих ФВЛЖ ≤35%, II–IV ФК при наличии у них БПНПГ или неспецифического нарушения проводимости при длительности QRS ≥150 мс (класс рекомендаций IIb, уровень доказанности B) [57, 59].
Имплантация СРТ/СРТ-Д не показана пациентам с СНнФВ II–IV ФК при наличии у них БПНПГ или неспецифического нарушении проводимости при длительности QRS <150мс (класс рекомендаций III, уровень доказанности B) [57, 59].
Имплантация СРТ/СРТ-Д должна быть рассмотрена у пациентов с СНнФВ II–IVФК c постоянной формой ФП при ФВЛЖ ≤35%, несмотря на ОМТ, при длительности QRS >130 мс, наличии БЛНПГ и проведенной или планируемой радиочастотной катетерной абляции атрио-вентрикулярного узла (класс рекомендаций IIa, уровень доказанности B) [60, 61], или при фармакологическом контроле ЧСС, который обеспечивает более 95% навязанных комплексов (класс рекомендаций IIb, уровень доказанности C) [62, 63] с целью снижения риска смерти и улучшения клинического течения СН.
Имплантация СРТ/СРТ-Д противопоказана пациентам с СНнФВ II–IV ФК при продолжительности QRS <130 мс (класс рекомендаций III, уровень доказанности A) [64–67].
Имплантируемый кардиовертердефибриллятор (ИКД)
ИКД рекомендуется больным с ожидаемой продолжительностью жизни более 1 года для вторичной профилактики внезапной сердечной смерти (ВСС), пережившим фибрилляцию желудочков или желудочковую тахикардию с нестабильной гемодинамикой, либо с потерей сознания, которые произошли спустя 48 часов после ИМ, а также в том случае, если нет обратимых причин возникновения этих нарушений ритма (класс рекомендаций I, уровень доказанности A) [68].
ИКД рекомендуется всем больным СН II–III ФК после перенесенного не менее 40 дней назад ИМ при ФВ ЛЖ ≤35% с целью первичной профилактики ВСС (класс рекомендаций I, уровень доказанности A) [69, 70].
ИКД рекомендуется всем больным ХСН II–III ФК неишемической этиологии при ФВЛЖ≤35% с целью профилактики ВСС (класс рекомендаций IIb, уровень доказанности A) [70].
ИКД может быть рекомендован больным ХСН I ФК при ФВЛЖ≤30% с ишемической дисфункцией ЛЖ спустя 40 дней после перенесенного ИМ и при неишемической ХСН для предотвращения риска внезапной сердечной смерти (класс рекомендаций I, уровень доказанности B) [69, 71] или при неишемической ХСН (класс рекомендаций IIb, уровень доказанности B) [71].
ИКД не показан пациентам при IV ФК ХСН, сохраняющемся несмотря на ОМТ, у которых невозможно достижение компенсации и благоприятного прогноза и не планируется трансплантация сердца, имплантация искусственного ЛЖ и нет показаний к СРТ (класс рекомендаций III, уровень доказанности C).
Для пациентов с ХСН IVФК, ожидающих постановки искусственного ЛЖ или трансплантации сердца, имплантация ИКД возможна по решению команды, состоящей из кардиолога, электрофизиолога и кардиохирурга (класс рекомендаций IIb, уровень доказанности C).
Иное лечение
Ограничение потребления соли
При ХСН IФК следует не употреблять соленую пищу (натрий до 3 г/сут, что соответствует 7,5 г соли), при II ФК – не подсаливать пищу (натрий 1,5–2 г/сут, что соответствует 4–5 г соли), ФК III–IV – использовать продукты с пониженным содержанием соли и готовить блюда без соли (натрий – 1 г/сут, что соответствует <3 г соли).
В период активной диуретической терапии ограничение натрия и соли умеренное (натрий <3г/сут, соль <7 г/сут) – после достижения компенсации согласно ФК ХСН.
Ограничение потребления жидкости
Ограничение потребления жидкости актуально только в крайних ситуациях: при декомпенсированном тяжелом течении ХСН, требующем в/в введения диуретиков.
В обычных ситуациях объем жидкости составляет менее 2 л/сутки (минимум приема жидкости – 1,5 л/сут.).
Контроль массы тела
Прирост веса >2кг за 1–3 дня скорее всего свидетельствует о задержке жидкости в организме и риске развития декомпенсации.
Наличие ожирения или избыточного веса ухудшает прогноз больного ХСН, и во всех случаях ИМТ более 25 кг/м2 требует специальных мер и ограничения калорийности питания.
Прогрессирующее уменьшение массы тела (при исходном ИМТ менее 19 кг/м2), обусловленное потерей как жировой ткани, так и мышечной массы, называется сердечной кахексией – документированная непреднамеренная потеря массы тела на 5 и более килограмм или более чем на 7,5% от исходной массы в компенсированном состоянии за6месяцев[72,73].Влечениитакихбольныхнеобходимым является сочетание медикаментозной коррекции нейрогормональных расстройств (класс рекомендаций I, уровень доказанности А), блокады цитокинов (класс рекомендаций IIb, уровень доказанности С) и нутритивной поддержки (класс рекомендаций IIb, уровень доказанности С) [74–78].
Алкоголь
Алкоголь строго запрещен больным с алкогольной кардиомиопатией. У пациентов с ишемическим генезом ХСН употребление до 20 мл этанола в сутки может способствовать улучшению прогноза [79, 80].
Реабилитация
Важнейшей частью реабилитации пациентов с ХСН являются физические тренировки. Аэробные физические тренировки умеренной интенсивности способствуют улучшению функциональных возможностей, приводят к улучшению качества жизни и снижению количества госпитализаций по поводу ХСН у пациентов с СН со сниженной ФВЛЖ (класс рекомендаций I, уровень доказанности A). У пациентов с сохраненной ФВ регулярное выполнение аэробных физических нагрузок умеренной интенсивности влияет на уменьшение симптоматики и улучшение функционального статуса (класс рекомендаций I, уровень доказанности A) [52, 81–84].
Основным для выбора режима нагрузок является определение исходной толерантности при помощи КПНТ. Пациенты с СН со значением пиковой VО2 менее 10 мл/кг/мин и VE/VСО2 более 40 относятся к группе высокого риска и отличаются особенно неблагоприятным прогнозом [85, 86]. При невозможности проведения КПНТ проводят тест 6‑мин ходьбы (класс рекомендаций IIa, уровень доказанности C).
Для пациентов, преодолевающих менее 150 м, т.е. относящихся к IV ФК, а также имеющих выраженный дефицит массы тела, кахексию, общепринятые физические нагрузки не показаны. В этих случаях на первом этапе (период стабилизации состояния) пациент выполняет упражнения для тренировки мышц вдоха и выдоха (класс рекомендаций I, уровень доказанности С) [87, 88]. При стабилизации состояния пациента необходимо повторить 6МТХ. При выполнении 6МТХ более 200 м целесообразно рекомендовать физические нагрузки в виде ходьбы.
Метод усиленной наружной контрпульсации может быть рекомендован, как дополнительный метод лечения пациентов с ХСН II–III ФК в период полной компенсации на ОМТ для увеличения толерантности к физическим нагрузкам и улучшения качества жизни (класс рекомендаций IIb, уровень доказанности B).
Профилактика и диспансерное наблюдение
Медикаментозная профилактика
Ингибиторы КоА-редуктазы (статины) рекомендуются всем больным (даже среднего и низкого СС риска) с целью профилактики развития сердечно-сосудистых осложнений (ССО), включая ОИМ и вновь развившуюся ХСН, и достижения целевого уровня ХС ЛПНП (класс рекомендаций I, уровень доказанности A). Необходимо назначение статинов с контролем ХС ЛПНП больным ИБС как после ОИМ, так и без перенесенного ОИМ с целью профилактики развития ХСН (класс рекомендаций I, уровень доказанности A) [89–92].
Можно назначить комбинацию блокаторов РААС с диуретиками для контроля АД больным даже среднего (низкого) сердечно-сосудистого риска и с уровнем САД >140 мм рт.ст. с целью профилактики развития ССО, в том числе вновь развившуюся ХСН (класс рекомендаций IIb, уровень доказанности B).
После перенесенного ОИМ в качестве профилактики ремоделирования сердца и развития ХСН необходимо использовать различные нейрогормональные модуляторы: β-АБ [93, 94], иАПФ [95–97], АРА [98] и АМКР [99]. Причем сочетание β-АБ с блокадой ренин-ангиотензиновой системы увеличивает эффект терапии [98, 100] (класс рекомендаций I, уровень доказанности A).
Больным АГ с высоким или очень высоким сердечно-сосудистым риском необходимо назначение антигипертензивного лечения с достижением уровня АД <140/90 мм рт.ст. для предотвращения развития ССО, в том числе и вновь развившейся ХСН (класс рекомендаций I, уровень доказанности A).
У больных АГ с высоким или очень высоким сердечно-сосудистым риском можно рассмотреть более строгий контроль АД <130/80 мм рт.ст. с целью дополнительного снижения риска развития новых случаев ХСН (класс рекомендаций IIb, уровень доказанности B).
Предпочтительными антигипертензивными средствами, позволяющими предотвращать развитие ХСН, являются блокаторы РААС, диуретики и β-АБ, менее выгодно использование дигидропиридиновых БМКК (класс реко- мендаций I, уровень доказанности A).
Необходимо назначение иАПФ (предпочтительнее периндоприла или рамиприла) больным ИБС без перенесенного ОИМ и с промежуточной или сохраненной ФВЛЖ для предотвращения ХСН (класс рекомендаций I, уровень доказанности A).
Можно назначить АРА больным ИБС без перенесенного ОИМ и с сохраненной ФВ ЛЖ, однако доказательств предотвращения ХСН при таком лечении нет и использование иАПФ предпочтительнее (класс рекомендаций IIb, уровень доказанности B).
Применение нитратов, β-АБ, аспирина, БМКК не способствует предотвращению (профилактике) развития ХСН, и их использование диктуется клиникой коронарной болезни сердца (класс рекомендаций III, уровень доказанности A).
Наличие СД и инсулинорезистентность предрасполагают к развитию ХСН, причем максимальная степень увеличения риска отмечается у женщин [101, 102]. Сочетание ХСН с СД усугубляет неблагоприятный прогноз пациентов [103–105], поэтому успешное лечение этих пациентов с нормализацией уровня HbA1C (гликемии) позволяет существенно уменьшать риск развития ХСН [106–111] (класс рекомендаций I, уровень доказанности A).
Метформин должен быть средством выбора при лечении СД 2 типа с целью профилактики ХСН, возможного уменьшения риска госпитализаций и улучшения прогноза у больных с сочетанием ХСН и СД при отсутствии прямых противопоказаний (класс рекомендаций IIa, уровень доказанности B).
Необходимо рассмотреть назначение препаратов класса ингибиторов натрий-глюкозного ко-транспортера 2 типа (SGLT-2 ингибиторы) для снижения риска смерти и развития новых случаев ХСН при минимуме побочных реакций и отсутствии гипогликемии (класс рекомендаций IIa, уровень доказанности B).
Использование инсулина и препаратов сульфонилмочевины возможно только при наличии прямых показаний для лечения СД, т.к. доказательств их положительного влияния на риск развития и течение ХСН не имеется. Влияние ингибиторов дипептилпептидазы-4 (ДПП-4) (следует отдать предпочтение ситаглиптину и избегать назначения саксаглиптина) и агонистов глюкагоноподобного пептида (ГПП-1) на ХСН в лучшем случае нейтральное (класс рекомендаций IIb, уровень доказанности B).
Применение тиазолидиндионов противопоказано при лечении СД 2 типа у больных с риском ХСН и клинически выраженной ХСН в связи с задержкой жидкости и ухудшением прогноза (класс рекомендаций III, уровень доказанности B).
Диспансерное наблюдение
Лечение больных ХСН в рамках диспансерного наблюдения (табл.9). Цели терапии больных ХСН в рамках диспансерного наблюдения предполагают:
К универсальным рекомендациям независимо от типа и выраженности ХСН относятся: ограничение потребления соли, нормализация и контроль массы тела, отказ от курения и алкоголя, регулярная аэробная циклическая физическая нагрузка с учетом результатов 6МТХ, вакцинация гриппозной и пневмококковой вакциной.
| Заболевание, состояние | Регулярность профилактических посещений | Рекомендуемые вмешательства и методы исследования во время профилактических посещений |
|---|---|---|
ХСН I–IIА стадии, стабильное состояние |
Не менее 1 раза в год |
|
ХСН IIБ–III стадии, стабильное состояние |
Не менее 2 раз в год |
|
Диспансерное наблюдение пациентов с ХСН осуществляют:
-
врач-терапевт (врач-терапевт участковый, врач-терапевт участковый цехового врачебного участка, врач общей практики (семейный врач);
-
фельдшер фельдшерско-акушерского пункта (фельд шерского здравпункта) в случае возложения на него руководителем медицинской организации отдельных функций лечащего врача, в том числе по проведению диспансерного наблюдения в установленном порядке.
Вопросы консультирования по коррекции ФР могут быть возложены на врача (фельдшера) отделения (кабинета) медицинской профилактики и/или врача (фельдшера) центра здоровья.
Проведение школ по СН для пациентов и их родственников способствует лучшему пониманию плана лечения, что в конечном итоге приводит к большей приверженности пациентов и улучшению клинических исходов. Проведение школ пациентов на базе стационаров, как правило, более эффективно вследствие большей сосредоточенности пациентов на своем состоянии (класс рекомендаций I, уровень доказанности А).
Удаленный контроль пациентов с помощью телефонных звонков с использованием структурированных опросников также может значительно улучшать показатели клинических исходов (смертность и сердечно-сосудистые госпитализации) на 38% [111–118].
Дополнительная информация, влияющая натечение иисход заболевания/синдрома
Острая декомпенсация ХСН
Термином «острая декомпенсированная СН» (ОДСН) принято называть период течения ХСН, который характеризуется быстрым усугублением симптомов СН, что требует экстренной госпитализации пациента и проведения интенсивной терапии. Каждый эпизод ОДСН ухудшает прогноз больного ХСН и требует как специализированного лечения, так и временной коррекции предшествующей терапии ХСН [119, 120].
Причины ОДСН: быстрое прогрессирование собственно ХСН, возникновение острых состояний (ОИМ, ТЭЛА, острых клапанных поражений и т.д.), декомпенсация на фоне обострения сопутствующей патологии (пневмонии, других инфекций, нарушения функции почек, анемии, аденомы предстательной железы, пароксизма фибрилляции предсердий, декомпенсации СД и т.д.) [121, 122].
Диагностические тесты у пациентов с подозрением на ОДСН
У пациентов с ОДСН необходимо исключить наличие причин, требующих незамедлительно специального лечения, и обеспечить проведение дифференциального диагноза между ОДСН и другими состояниями пациентов (табл. 10).
Рентгенография легких
Рентгенография легких позволяет определить выраженность застойных явлений, выявить наличие жидкости в плевральной полости и кардиомегалии, а также диагностировать «не ССЗ», вызывающие прогрессирование ХСН (например, пневмонию) (класс рекомендаций I, уровень доказанности С). Следует помнить, что тяжесть ОДСН не всегда коррелирует с рентгенографической картиной [123] и что рентгенография легких в положении лежа обладает меньшей диагностической ценностью, чем исследование в положении стоя.
Электрокардиограмма (ЭКГ)
ЭКГ позволяет определить наличие ишемии миокарда, фибрилляции предсердий и других причин ОДСН; наличие нормальной ЭКГ маловероятно у пациента с ОДСН [124] (класс рекомендаций I, уровень доказанности С). ЭКГ в 12 стандартных отведениях необходимо зарегистрировать в течение 10 мин после контакта с мед.персоналом, если есть подозрение на ОКС или аритмии, и в течение 30 минут в остальных случаях.
Эхокардиграфия (ЭхоКГ)
ЭхоКГ позволяет исключить жизнеугрожающие состояния (ОИМ, ТЭЛА, диссекцию аорты), определить ФВ ЛЖ, размеры сердца, систолическое давление в легочной артерии, сделать косвенную оценку давления заклинивания легочной артерии и центрального венозного давления (класс рекомендаций I, уровень доказанности С). ЭхоКГ необходимо провести незамедлительно у гемодинамически нестабильных пациентов и у пациентов с подозрением на наличие острых угрожающих жизни состояний. Остальным пациентам целесообразно провести ЭхоКГ в первые 48 часов, если ФВ ЛЖ и размеры сердца неизвестны или показатели могли измениться с момента последнего исследования.
Симптомы застоя (левостороннего) |
Ортопноэ, приходящая ночная одышка, влажные двусторонние хрипы в легких. |
Симптомы застоя (правостороннего) |
Расширение яремных вен, периферические отеки, застойная печень, гепатоюгулярный рефлюкс, асцит, симптомы застойного кишечника. |
Симптомы/признаки гипоперфузии |
Клинические: холодные влажные конечности, олигурия, заторможенность (mental confusion), головокружение, слабый пульс. |
Гипотензия |
САД <90 мм рт. ст. |
Брадикардия |
ЧСС <40 уд/мин |
Тахикардия |
ЧСС >120 уд/мин |
Нарушение дыхания |
ЧДД >25 в мин c участием вспомогательной мускулатуры; ЧДД <8 в мин, несмотря на одышку. |
Снижение сатурации кислорода |
Сатурация O2 (SaO2) < 90% по данным пульсоксиметрии. |
Гипоксемия |
Парциальное давление кислорода (PaO2) в артериальной крови <80 мм рт. ст. (<10,67 кПа) (анализ газов крови) |
Гипоксемическая форма дыхательной недостаточности |
PaO2 <60 мм рт. ст. (<8 кПа) |
Гиперкапния |
Парциальное давление углекислого газа (PаCO2) в артериальной крови >45 мм рт. ст. (>6 кПа) (анализ газов крови) |
Гиперкапническая дыхательная недостаточность |
PACO2 >50 мм рт. ст. (>6,65 кПа) |
Ацидоз |
pH <7,35 |
Повышение уровня молочной кислоты в крови |
>2 ммоль/л |
Олигурия |
Выделение мочи <0,5 мл/кг/час |
Натрийуретические пептиды
Определение натрийуретических пептидов позволяет исключить несердечные причины симптомов, расцениваемые, как проявление прогрессирования ХСН (класс рекомендаций I, уровень доказанности A) [19, 125–127]. При уровне BNP <100 пг/мл и/или NT-proBNP <300 пг/мл наличие ОДСН маловероятно.
Сердечный тропонин
Тест применяется для исключения ОКС и определения прогноза пациентов (класс рекомендаций I, уровень доказанности C).
Креатинин и электролиты
Тест применяется для подбора и коррекции терапии; рекомендовано проводить 1 раз в 1–2 дня и чаще при необходимости (класс рекомендаций I, уровень доказанности С).
Показания к госпитализации
Показания к госпитализации (переводу) в отделение интенсивного наблюдения включают гемодинамическую нестабильность, или выраженную (прогрессирующую) одышку (класс рекомендаций I, уровень доказанности C), и/или рецидивирующую жизнеугрожающую аритмию, и/или другие жизнеугрожающие состояния (ОКС, гипертонический криз, разрывы сердца как осложнения ОКС, травму грудной клетки, острую недостаточность клапанов сердца, ТЭЛА) (класс рекомендаций I, уровень доказанности C) (рис.3).
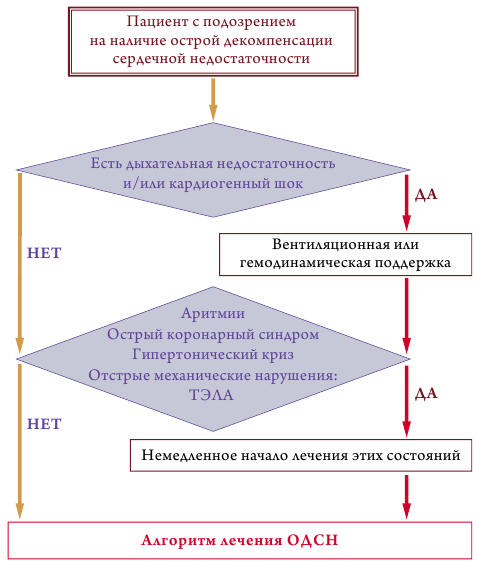
Критерии госпитализации и направления в отделение интенсивного наблюдения
Пациенты с гемодинамической нестабильностью или выраженной непроходящей одышкой должны находиться в отделении, где есть возможность оказать незамедлительные реанимационные мероприятия (класс рекомендаций I, уровень доказанности C);
Пациенты с рецидивирующими аритмиями или ОДСН, вызванной/сопровождающейся наличием острых жизнеугрожающих состояний – ОКС, гипертоническим кризом, аритмиями, острыми механическими нарушениями (механическими осложнениями ОКС, травмой грудной клетки, острой недостаточностью клапанов сердца, связанной с эндокардитами, диссекцией аорты, тромбозом, ТЭЛА), должны госпитализироваться в отделения интенсивного наблюдения (класс рекомендаций I, уровень доказанности C).
Первичная тактика ведения пациентов, госпитализированных в связи с ОДСН (рис.3)
Пациенту необходимо незамедлительно обеспечить гемодинамическую и/или респираторную поддержку при наличии кардиогенного шока и/или дыхательной недостаточности (класс рекомендаций I, уровень доказанности C).
В течение 60–120 мин после поступления пациента в стационар необходимо провести диагностику и незамедлительно начать лечение жизнеугрожающих состояний, к которым относятся ОКС, гипертонический криз, аритмии, острые механические нарушения (разрывы сердца как осложнения ОКС, травма грудной клетки, острая недостаточность клапанов сердца), ТЭЛА (класс рекомендаций I, уровень доказанности C). Подробнее лечение этих состояний описано в профильных рекомендациях.
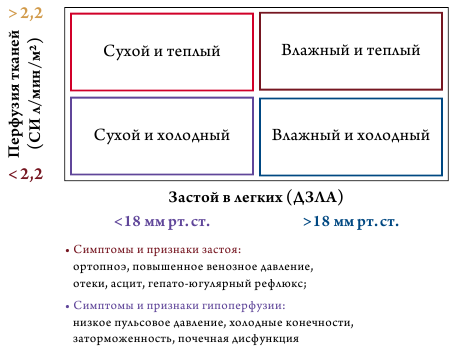
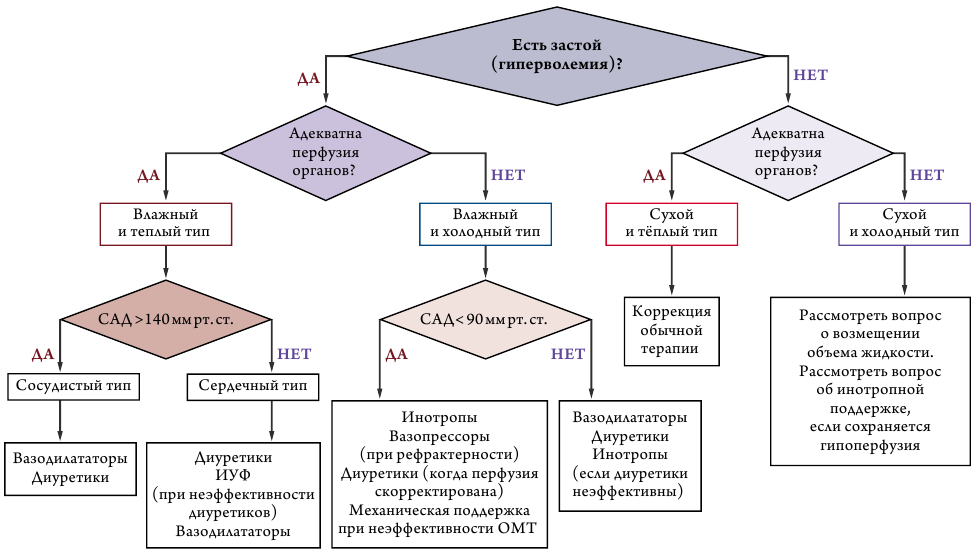
Для выбора тактики ведения пациентов необходимо определить гемодинамический тип пациента на основании классификации J. S. Forrester 1977 года [128] и L. W. Stevenson [129] (рис. 4).
Ведение пациентов в зависимости от гемодинамического профиля пациента представлено на рис. 5.
Оксигенотерапия
Рекомендовано чрескожное мониторирование насыщения крови кислородом (класс рекомендаций I, уровень доказанности C).
Измерение pH венозной крови и определение парциального давления CO2 в венозной крови должны быть рассмотрены у пациентов c острым отеком легких или ХОБЛ. У пациентов с кардиогенным шоком для определения показателей кислотно-щелочного состояния рекомендовано использовать артериальную кровь (класс рекомендаций IIa, уровень доказанности С).
Рутинная оксигенотерапия нецелесообразна у пациентов с ОДСН, не имеющих гипоксемии, так как она может приводить к вазоконстрикции и снижению сердечного выброса [130, 131] (класс рекомендаций I, уровень доказанности C).
Оксигенотерапия показана при SpO2 <90% или PaO2 <60 мм рт. ст. с целью коррекции гипоксемии (класс рекомендаций I, уровень доказанности C).
Неинвазивная вентиляция с положительным давлением (CPAP – терапия и BiPAP-терапия) должна быть рас- смотрена у пациентов с респираторным дисстресом (ЧДД >25 в мин, SpO2 <90%), ее следует начать как можно раньше с целью уменьшения выраженности респираторного дисстресса и снижения потребности в интубации (класс рекомендаций IIa, уровень доказанности B) [132, 133].
Неинвазивная вентиляция легких может снижать АД, в связи с чем ее следует с осторожностью применять у пациентов с гипотонией.
Интубация показана при дыхательной недостаточности с гипоксемией (PaO2 <60 мм рт. ст. (8 кПа), гиперкапнией (PaCO2 >50 мм рт. ст. (6,65 кПа)) и ацидозом (pH <7,35) при отсутствии возможности неинвазивной коррекции вентиляционных расстройств (класс рекомен- даций I, уровень доказанности С).
Диуретики
Диуретики показаны при наличии отечного синдрома (класс рекомендаций I, уровень доказанности С). При ОСН (ОДСН) диуретики назначаются по принципу quantum satis для получения БЫСТРОГО гарантированного диуретического ответа.
Оптимально внутривенное болюсное использование эффективных доз торасемида или фуросемида [134].
При рефрактерности к используемым дозам петлевых диуретиков можно использовать несколько тактик ее преодоления: добавление малых доз тиазидных диуретиков в дополнение к петлевым диуретикам (класс рекомендаций IIa, уровень доказанности B) [135], применение петлевых диуретиков в комбинации с большими (150–300 мг) дозами АМКР (класс рекомендаций I, уровень доказанности C) [135–137], применение активных диуретиков с ингибиторами карбоангидразы (ацетазоламидом), что позволяет избежать развития алкалоза, в условиях которого ослабевает действие тиазидных и петлевых диуретиков (класс рекомендаций IIa, уровень доказанности B) [138].
При неэффективности других способов дегидратации возможно применение ультрафильтрации (класс рекомендаций IIb, уровень доказанности B) [139].
| Вазодилататор | Показания | Доза |
|---|---|---|
Нитроглицерин |
Застой в МКК, отек легких, САД ≥90 мм рт. ст. |
Стартовая 10-20 мкг/мин с увеличением до 200 мкг/мин |
Изосорбид динитрат |
Застой в МКК, отек легких, САД ≥90 мм рт. ст. |
Стартовая 1 мг/час с увеличением до 10 мг/час |
Нитропруссид натрия |
Застой в МКК, отек легких, САД ≥90 мм рт. ст. |
Стартовая 0,3 мкг/кг/мин с увеличением до 5 мкг/кг/мин |
Серелаксин |
Застой в МКК, САД >125 мм рт. ст. Дополнительные - поражение органов-мишеней, особенно почек |
Рекомендуемая доза 30 мкг/кг/сут. |
Вазодилататоры
Вазодилататоры показаны при лечении ОДСН, поскольку за счет венодилатации снижаются преднагрузка и давление в малом круге кровообращения (МКК), купируя симптомы отека легких. Одновременно за счет дилатации артериол и снижения посленагрузки вазодилататоры облегчают опорожнение скомпрометированного ЛЖ.
Применение нитроглицерина, изосорбида динитрата, нитропруссида натрия может быть рассмотрено только у пациентов с АД ≥100 мм рт. ст. (класс рекомендаций IIA B) [140–142].
Применение серелаксина (вазодилататора и диуретика с дополнительной защитой органов-мишеней – почек, печени), единственного препарата, улучшающего длительный прогноз больных при ОДСН, должно быть рассмотрено у пациентов с САД >125 мм рт. ст. (класс рекомендаций IIa, уровень доказанности B) [141].
При назначении вазодилататоров следует основываться на рекомендациях, представленных в таблице 11.
Препараты с положительным инотропным действием
В настоящий момент в арсенале врачей нет «чистых» препаратов с положительным инотропным эффектом. Препараты условно можно разделить на дериваты катехоламинов (допамин, добутамин), положительные инотропные с вазодилатирующим эффектом (левосимендан, милринон) и сердечные гликозиды, каждый из которых имеет свои особенности действия.
Препараты показаны пациентам с низким сердечным выбросом, сохраняющимися явлениями застоя, гипоперфузии, несмотря на применение вазодилататоров и/или диуретиков (класс рекомендаций IIb, уровень доказанности C).
Применение препаратов с положительным инотропным эффектом нецелесообразно у пациентов без симптомной гипотензии и/или гипоперфузии (класс рекомендаций III, уровень доказанности А) [142–144].
Длительное применение препаратов с положительным инотропным эффектом (за исключением дигоксина) отрицательно влияет на прогноз пациентов с ХСН [145, 146], поэтому их применение должно ограничиваться лишь острым периодом гипоперфузии и симптоматичной гипотензии, не корригируемой препаратами других классов (класс рекомендаций IIb, уровень доказанности B).
При назначении положительных инотропных препа- ратов следует основываться на рекомендациях, представ- ленных в таблице 12.
| Название препарата | Болюс | Скорость инфузии |
|---|---|---|
Добутамин |
Нет |
2-20 мкг/кг/мин |
Допамин |
Нет |
3-5 мкг/кг/мин - инотропное >5 мкг/кг/мин - вазопрессорное действие |
Левосимендан |
12 мкг/кг в течение 10 мин |
0,1 мкг/кг/мин, доза может быть увеличена до 0,2 мкг/кг/мин или уменьшена до 0,05 мкг/кг/мин. |
Норадреналин |
Нет |
0,2-1,0 мкг/кг/мин |
Адреналин |
1 мг в случае реанимационных мероприятий, возможно повторение через 3-5 мин |
0,05-0,5 мкг/кг/мин |
Допамин в малых дозах (1–3 мкг/кг/мин) оказывает допаминэргический эффект и стимулирует диурез, а в больших (>5 мкг/кг/мин) стимулирует β- и α-рецепторы, что приводит к увеличению ЧСС и вазоконтрикции, и используется так же, как и добутамин, у пациентов с крайне низким АД и выраженной гипоперфузией при гипотонии и рефрактерном отечном синдроме. Применение низких доз допамина не приводит к улучшению функции почек и увеличению эффективности диуретиков, вместе с тем при длительном наблюдении допамин не оказывал негативного влияния на прогноз (класс рекомендаций IIa, уровень доказанности A).
Применение левосимендана не показало преимуществ по сравнению с добутамином и сопровождалось большим риском нарушений сердечного ритма, что диктует соблюдение особой осторожности при использовании этого препарата при ОДСН [147] (класс рекомендаций IIb, уровень доказанности B).
Коррекция основной терапии у пациентов с ОДСН
В большинстве случаев терапия ХСН должна быть продолжена с возможной корректировкой доз препаратов.
Прием иАПФ и АРА должен продолжаться, кроме случаев выраженной гипотонии (менее 85/60 мм рт. ст.) (класс рекомендаций I, уровень доказанности B). Если пациент ранее не принимал препарат, назначение иАПФ/АРА должно быть произведено сразу же после стабилизации уровня АД пациента (класс рекомендаций I, уровень доказанности A) [148].
Прием β-АБ должен продолжаться при ОДСН, кроме случаев выраженной гипотонии (менее 85/60 мм рт. ст.) или брадикардии менее 50 уд/мин (класс рекомендаций IIa, уровень доказанности В) [149]. Если пациент не принимал ранее β-АБ, то они должны быть назначены только после стабилизации состояния. Терапия начинается с малой дозы (1/8 терапевтической) и постепенным (раз в 2 недели) повышением до максимально переносимой (класс рекомендаций I, уровень доказанности A) [150–152].
Прием АМКР должен быть продолжен, а если они не применялись ранее, их назначение может быть сделано в первые часы после наступления ОДСН (класс рекомендаций I, уровень доказанности C).
Дигоксин должен быть назначен с соблюдением мер предосторожности (см. раздел консервативное лечение). У больных, ранее не принимавших дигоксин, его назначение должно быть рассмотрено при тахисистолической форме ФП (класс рекомендаций IIa, уровень доказанно- сти C) и при синусовом ритме в случае наличия несколь- ких эпизодов ОДСН в течение года, низкой ФВ ЛЖ ≤25%, дилатации ЛЖ и высокого ФК (III–IV) вне эпизода ОДСН (класс рекомендаций IIa, уровень доказанности B) [36].
Продолжение приема ивабрадина во время эпизода ОДСН возможно. Доказательств его эффективности при острой СН нет, однако его длительное применение может предотвращать новые обострения СН (класс рекомендаций IIA B) [153].
После купирования эпизода ОДСН должно быть продолжено лечение по общим правилам лечения ХСН. Наличие частых повторных госпитализаций у пациента свидетельствует о возможных проблемах с соблюдением рекомендаций по образу жизни, приверженности к медикаментозной терапии, полноценности доз основной медикаментозной терапии, адекватности диуретической терапии. У пациентов с синусовым ритмом, не получающих дигоксин, следует рассмотреть вопрос о его добавлении в схему лечения (класс рекомендаций IIa, уровень доказанности B).
Нарушение функции почек
Распространенность нарушений функции почек при СН, по данным различных исследований, колеблется от 25 до 60% [154–156]. Чаще всего в этой популяции пациентов с первичным поражением сердца встречаются варианты кардиоренального синдрома 1-го и 2-го типов, которые соответствуют гемодинамическому варианту развития этого синдрома по новой классификации и описываются терминами «острое повреждение почек» и «хроническая болезнь почек» [157–159].
Диагностическими критериями острого повреждения почек (ОПП) являются повышение уровня сывороточного креатинина хотя бы на >0,3 мл/дл (26,5 мкмоль/л) в течение 48 часов, либо в 1,5 раза в течение предшествующих 7 дней и/или снижение диуреза менее 0,5 мл/кг/ч за 6 часов [160]. Стадия ОПП определяется на основании уровня креатинина и/или диуреза (табл. 13).
| Стадия | Критерии креатинина сыворотки* | Критерии диуреза* |
|---|---|---|
1 |
Повышение уровня креатинина в 1,5-1,9 раза от исходного уровня или на >0,3 мг/дл (>26,5 мкмоль/л) |
<0,5 мл/кг/часв течение 6-12 часов |
2 |
Повышение уровня креатинина в 2,0-2,9 раза от исходного уровня |
<0,5 мл/кг/час в течение >12 часов |
3 |
Повышение уровня креатинина в 3,0 раза от исходного уровня или на >4,0 мг/дл (>353,6 мкмоль/л) или начало заместительной почечной терапии, или снижение СКФ <35 (мл/мин/1,73 м2) у пациентов младше 18 лет |
<0,3 мл/кг/час за >24 часа или анурия >12 часов |
* - ОПП диагностируется при наличии хотя бы одного из критериев
| Неизменяемые | Изменяемые |
|---|---|
Возраст >65 лет Мужской пол* Черная раса |
Ятрогенная гипоперфузия почек, гиповолемия, прием мочегонных на фоне низконатриевой диеты, артериальная гипотония, прием иАПФ и АРА, прием НПВП, прием препаратов золендроновой кислоты, применение рентгеноконтрастных средств, злоупотребление алкоголем. |
* - при кардиохирургических вмешательствах и рентгенконтрастных процедурах – женский пол
Ассоциированные состояния:
ХБП ст. 3–5, анемия, диабетическая нефропатия, АГ, ХСН II–IV ФК, билатеральный стеноз почечных артерий, сепсис, системные васкулиты и заболевания соединительной ткани, множественная миелома, заболевания и состояния с нарушением выделения мочи (рак мочевого пузыря, рак предстательной железы, доброкачественная гиперплазия предстательной железы, мочекаменная болезнь, рак шейки
матки, рак толстой кишки), оперативные вмешательства, тяжелые заболевания печени, трансплантация органов и тканей.
| ФР | Нет ХБП | ХБП С1-2 ст. | ХБП С3-5 ст. |
|---|---|---|---|
Нет ФР и ассоциированных состояний |
Низкий риск |
Средний риск |
Высокий риск |
1-2 ФР |
Средний риск |
Средний риск |
Очень высокий риск |
3 и более ФР |
Высокий риск |
Высокий риск |
Очень высокий риск |
Ассоциированные состояния |
Очень высокий риск |
Очень высокий риск |
Очень высокий риск |
Риск развития ОПП повышается как в присутствии ФР ОПП, так и при наличии состояний, повышающих восприимчивость пациента к ФР ОПП (табл. 14, 15).
Причина ОПП должна быть установлена во всех случаях, когда это возможно. Профилактика ОПП должна быть основана на своевременном выявлении, минимизации или устранении ФР и ассоциированных состояний (класс рекомендаций I, уровень доказанности A); пациентам с риском развития ОПП показана консультация нефролога.
Пациенты с ОПП должны наблюдаться в течение 3-х месяцев для оценки степени восстановления функции почек и выявления повторных эпизодов ОПП или ухудшения течения прежде имевшей место ХБП.
Рекомендуется рассчитывать СКФ по формуле CKD-EPI, кроме особых ситуаций, а количественное определение альбуминурии (АУ) в разовой или утренней моче проводить с поправкой на уровень креатинина мочи. Если отношение альбумина к креатинину в моче (альбумин/креатинин) >30 мг/г (>3 мг/ммоль), результат необходимо подтвердить повторными анализами через 3 месяца или ранее. Если признаки ХБП отсутствуют, рекомендуется ежегодный контроль вышеназванных показателей.
У пациентов с ХБП необходимо оценивать уровень СКФ и АУ не реже одного раза в год, чаще следует мониторировать функцию почек у больных с высоким риском прогрессирования и в тех случаях, когда величины этих показателей следует учитывать при назначении терапии (табл. 16).
Классификация ХБП |
Альбуминурия* |
|||||||
A1 |
A2 |
A3 |
||||||
Норма или незначительно повышена |
Умеренно повышена |
Значительно повышена |
||||||
<30 мг/г (<3 мг/ммоль) |
30–300 мг/г (3–30 мг/ммоль) |
>300 мг/г (>30 мг/ммоль) |
||||||
Стадия |
Функция почек |
СКФ (мл/мин/1,73 м2) |
Уровень риска |
Частота контроля СКФ и альбуминурии в год |
Уровень риска |
Частота контроля СКФ и альбуминурии в год |
Уровень риска |
Частота контроля СКФ и альбуминурии в год |
1 |
Высокая или оптимальная |
>90 |
низкий |
1 при наличии ХБП |
умеренный |
1 |
высокий |
2 |
2 |
Незначительно снижена |
60-89 |
низкий |
1 при наличии ХБП |
умеренный |
1 |
высокий |
2 |
3а |
Умеренно снижена |
45-59 |
умеренный |
1 |
высокий |
2 |
очень высокий риск |
3 |
3б |
Существенно снижена |
30-44 |
высокий |
2 |
очень высокий риск |
3 |
очень высокий риск |
3 |
4 |
Резко снижена |
15-29 |
очень высокий риск |
3 |
очень высокий риск |
3 |
очень высокий риск |
4+ |
5 |
Почечная недостаточность |
<15 |
очень высокий риск |
4+ |
очень высокий риск |
4+ |
очень высокий риск |
4+ |
* - Альбуминурия – определяется отношение альбумин/креатинин в разовой (предпочтительно утренней) порции мочи, СКФ рассчитывается по формуле CKD-EPI.
Под прогрессированием ХБП понимают снижение уровня СКФ на категорию или больше. Пациентам с прогрессирующим течением ХБП необходима коррекция проводимой терапии, а также дополнительное обследование для выявления обратимых причин ухудшения функции почек.
Больные со СКФ >30 мл/мин/1,73 м2 (ХБП С 1–3) в большинстве случаев должны находиться под наблюдением терапевтов, а наблюдение нефролога показано всем больным со СКФ <30 мл/мин/1,73 м2 (ХБП С 4–5).
Нарушенная функция почек является важнейшим предиктором неблагоприятного прогноза у больных ХСН наравне с тяжестью ХСН и ФВ ЛЖ. При СКФ <60 мл/мин/1,73 м2 риск смертности увеличивается в 2,1 раза, при сниженной систолической функции ЛЖ риск смерти пациентов при наличии почечной недостаточности возрастает в 3,8 раза, при неизмененной систолической функции – в 2,9 раза. При выраженных нарушениях сократимости миокарда ЛЖ снижение СКФ, как правило, совпадает с появлением другого неблагоприятного маркера – увеличением плазменной концентрации натрий уретических пептидов [161, 162]. У трети больных с ОСН и в 25–70 % случаев острой декомпенсации ХСН развивается ОПП, которое ассоциируется с более продолжительной госпитализацией и большей частотой повторных госпитализаций по поводу декомпенсации СН, прогрессированием ХБП, повышением риска сердечно-сосудистой и общей смертности [160].
Сахарный диабет
Наличие СД и даже просто инсулинорезистентность предрасполагают к развитию ХСН, причем в максимальной степени увеличение риска отмечается у женщин [101, 102]. Сочетание ХСН с СД усугубляет неблагоприятный прогноз пациентов [103–105]. Поэтому успешное лечение пациентов с СД и его осложнениями позволяет существенно уменьшать риск развития ХСН (класс рекомендаций IIa, уровень доказанности А) [106–110]. Слудует, однако отметить, что линейной зависимости между гипогликемией и способностью предотвращать риск развития и прогрессирования ХСН в настоящее время нет.
Прием инсулина и препаратов сульфонилмочевины не улучшает течения ХСН, и их назначение рекомендуется лишь при невозможности контролировать уровень глюкозы другими способами (класс рекомендаций IIb, уровень доказанности B).
Первым выбором для больных с сочетанием ХСН и СД 2 типа является назначение метформина, способного замедлять прогрессирование ХСН, в том числе и при низкой ФВ ЛЖ и сочетании ХСН с нарушением функции почек (класс рекомендаций IIa, уровень доказанности B) [163, 164].
Другие инсулинсинсетайзеры, в том числе тиазолидиндионы (пиоглитазон и розиглитазон), ухудшают течение декомпенсации и риск задержки жидкости, а потому не могут быть рекомендованы при сочетании ХСН и СД 2 типа (класс рекомендаций III, уровень доказанности A) [165].
Ингибиторы фермента ДПП-4 (саксаглиптин, алоглиптин и ситаглиптин) в лучшем случае не ухудшают течение ХСН и не могут считаться приоритетными при сочетании декомпенсации и СД 2 типа (класс рекомендаций IIb, уровень доказанности B) [166–168]. Агонисты рецепторов ГПП-1 (эксенатид, лираглютид, албиглютид, дилаглютид, ликсизенатид), несмотря на умеренное снижение сердечно-сосудистого риска, также не оказали значимого влияния на риск ХСН (класс рекомендаций IIb, уровень доказанности B) [169, 170].
Наибольшее внимание в настоящее время уделяется препаратам класса ингибиторов натрий-глюкозного ко-транспортера 2 типа (SGLT-2), которые, кроме умеренного снижения уровня глюкозы, обладают натрий- и диуретическим свойствами, снижают уровень АД (дополнительно к иАПФ, АРА), уменьшают массу тела и предотвращают риск развития ХСН, в том числе и у пациентов с СД и сопутствующей сердечно-сосудистой патологией, включая саму ХСН. Эмпаглифлозин в проспективном рандомизированном клиническом исследовании доказал способность на 39% снижать риск развития ХСН [171]. Сходные результаты были продемонстрированы в мета-анализе исследований с дапаглиф- лозином [172]. Таким образом, необходимо рассмотреть назначение препаратов класса ингибиторов натрий-глюкозного ко-транспортера 2 типа (SGLT-2 ингибиторы), предпочтительнее эмпаглифлозина, для снижения риска смерти и развития новых случаев ХСН при минимуме побочных реакций и отсутствии гипогликемии (класс рекомендаций IIa, уровень доказанности B).
Алгоритм стратификации выбора инициирующей сахароснижающей терапии у больных ХСН и СД 2 типа с учетом вышеизложенных особенностей должен соответствовать общим принципам оказания специа лизированной помощи больным СД 2 типа, принятым в Российской Федерации [173].
Среди основных средств лечения ХСН у пациентов с СД преимущество имеют иАПФ и АРА, которые, с одной стороны, уменьшают риск развития диабета, а с другой – уменьшают шансы на развитие ХСН у больных СД [163]. В то же время применение β-АБ и диуретиков может ухудшать течение СД (класс рекомендаций IIb, уровень доказанности В) [106, 174]. Учитывая, что положительные эффекты β-АБ при СД сохраняются, отказываться от такой терапии у больных, перенесших ОИМ и имеющих симптомы ХСН, нецелесообразно [175]. В данном случае выбор должен быть сделан в пользу бисопролола, не ухудшающего чувствительность тканей к инсулину [176], или β-АБ с вазодилатирущими свойствами - карведилола, снижающего инсулинорезистентность [177], или небиволола, предупреждающего развитие инсулинорезистентности и новых случаев СД [33, 178]. Карведилол имеет достоверное преимущество перед метопрололом по контролю уровня сахара, а также по снижению риска прогрессирования диабета и появления новых случаев диабета у больных с уже развившейся ХСН (класс рекомендаций IIa, уровень доказанности B) [179, 180].
Сердечная недостаточность у больных ХОБЛ и/или бронхиальной астмой (БА)
Согласно результатам многочисленных исследований около 25-30% пациентов с ХСН имеют ХОБЛ, которая является независимым предиктором неблагоприятного прогноза при СН. Сопутствующая ХОБЛ часто способствует декомпенсации СН [181-183].
Определенные трудности представляет диагностика СН у больных ХОБЛ и/или бронихиальной астмой (БА), что обусловлено сходными клиническими симптомами. В связи с этим особую значимость приобретает определение уровня натрийуретических гормонов (BNP или NT-proBNP) и проведение ЭхоКГ [184-186]. Показано выполнение спирометрии в динамике, т.к. прогрессирование СН приводит к усилению тяжести ХОБЛ.
Лечение СН у пациентов с ХОБЛ и/или БА должно проводиться в соответствии с рекомендациями. Известно, что иАПФ и АРА у больных с ХОБЛ и СН способны улучшать альвеолярный газообмен, уменьшать вазоконстрик- цию и снижать давление в легочных сосудах [187, 188]. Определенную проблему может представлять клиническая оценка кашля у больных с сочетанием СН и ХОБЛ при приеме иАПФ.
Лечение селективными β-АБ является безопасным для больных ХОБЛ, приводит к незначительному снижению объема форсированного выдоха за 1 секунду (ОФВ1) без отрицательного воздействия на симптомы и качество жизни [189, 190]. Преимущества кардиоселективных β-АБ при СН явно превосходят любые потенциальные риски, связанные с ХОБЛ [191-193].
При невозможности назначения β-АБ (БА, крайне тяжелая ХОБЛ) у больных ХСН II—IV ФК с ФВ ЛЖ <40%, имеющих синусовый ритм с ЧСС >70 уд/мин, должен применяться ивабрадин для снижения риска суммы смертей и госпитализаций из-за ХСН (класс рекомендаций На, уровень доказанности С). Учитывая, с одной стороны, важность контроля ЧСС у больных ХСН для улучшения прогноза и, с другой стороны, высокий процент развития синусовой тахикардии у больных ХОБЛ в условиях длительного приема бронходилататоров, при использовании, как правило, β-АБ в низких и средних дозах и при сохранении симптомов СН, синусовом ритме и ЧСС >70 уд/мин следует назначать ивабрадин в дополнение к терапии β-АБ (класс рекомендаций IIa, уровень доказанности B).
Диуретики больным ХОБЛ следует назначать с осторожностью, начиная с небольших доз, так как при развитии правожелудочковой СН выброс больше зависит от преднагрузки, и чрезмерное сокращение внутрисосудистого объема жидкости может сопровождаться уменьшением наполнения ПЖ и снижением сердечного выброса.
При лечении ХОБЛ у пациентов с СН необходимо учитывать побочные эффекты бронходилататоров, в частности β~2`‑агонистов (тахикардия, экстрасистолия, гипокалиемия, гипомагниемия, увеличение риска внезапной сердечной смерти). В связи с этим следует на время прекратить применение β2‑агонистов у пациентов с тяжелой СН. Антихолинергические препараты длительного действия остаются препаратами первого выбора при лечении ХОБЛ в сочетании с СН.
Тревожно-депрессивные расстройства
У пациентов с СН часто формируются психические расстройства, проявляющиеся депрессивной и/или тревожной симптоматикой. Доля больных СН, страдающих такими расстройствами, достигает, по данным различных исследований, 14–38% [194, 195]. Симптомы депрессии чаще встречаются у женщин [194, 196]. Во многих клинических исследованиях было показано, что наличие депрессии может существенно ухудшать прогноз пациентов с СН: увеличивать количество госпитализаций и их продолжительность, негативно влиять на качество жизни [195, 197–200]. Симптомы депрессии и тревоги в подавляющем большинстве случаев отражают реакцию пациента на симптоматику сердечно-сосудистой патологии, которая угрожает как качеству, так и самой жизни пациентов, страдающих СН. Симптомы депрессии и тревоги подвергаются редукции, если тяжесть СН (а следовательно, и степень угрозы) снижается на фоне лечения [201, 202]. Депрессивная симптоматика у пациентов в подавляющем числе случаев является обратимой и снижается без специфической терапии на фоне улучшения соматического состояния [201]. Было показано, что увеличение суммы баллов по ШОКС является независимым (от других показателей ХСН, а также от пола и возраста) и модифицируемым (с помощью лечения) фактором, влияющим на депрессию и/или тревогу у больных ХСН [201]. Соответственно, подавляющему большинству больных ХСН с впервые выявленной симптоматикой депрессии и тревоги легкой степени выраженности не требуются консультация психиатра и назначение антидепрессантов. Однако всё вышеизложенное отнюдь не означает, что тревожно-депрессивная симптоматика у пациентов с СН должна оставаться без внимания. Известно, что пациенты с депрессией имеют более выраженное снижение когнитивных функций, а влияние депрессии на течение ХСН может проявляться через поведенческие факторы: низкую приверженность к здоровому образу жизни и соблюдению рекомендаций врача, а также более высокую склонность к бытовому поведению, увеличивающему сердечно-сосудистый риск, такому, как курение, малоподвижный образ жизни, несбалансированная диета и употребление алкоголя [202]. Для диагностики депрессивных расстройств у пациентов с СН валидирована шкала депрессии Бека (Beck Depression Inventory (BDI) [203]. В исследованиях, изучающих депрессию у пациентов с СН, активно используются также Шкала Депрессии Гамильтона (Hamilton Depression Scale), Госпитальная шкала тревоги и депрессии (Hospital Anxiety and Depression Scale), Гериатрическая шкала депрессии (Geriatric Depression Scale) [204–206]. При выборе метода лечения тревоги и депрессии легкой степени предпочтение должно отдаваться немедикаментозным методам ведения пациентов – обучению и активному амбулаторному контролю [111, 112, 207–212]. Обучение больных навыкам самоконтроля и самопомощи может выполнять роль психотерапевтического воздействия. Наиболее эффективным и научно обоснованным психотерапевтическим методом является когнитивная поведенческая терапия, в ходе которой добиваются большей адекватности переживаний и эмоций пациентов, правильной оценки угрозы, сопряженной с заболеванием. Однако этот метод требует специального обучения психотерапевта и соответствующих навыков [213]. Также в рамках мультидисциплинарных программ ведения пациентов с СН (Программы управления заболеванием) хорошую эффективность в отношении снижения симптоматики депрессии и тревоги показали физические тренировки (класс рекомендаций I, уровень доказанности А) [214, 215].
В настоящее время не существует убедительных данных положительного влияния лечения психотропными препаратами на прогноз и клиническую симптоматику у пациентов с СН [216, 217]. Если назначение антидепрессантов все же требуется, предпочтение должно отдаваться сертралину и эсциталопраму, безопасность которых была продемонстрирована у пациентов с СН (класс рекомендаций IIa, уровень доказанности B) [217, 218]. Пациентам с СН противопоказано назначение трициклических антидепрессантов (имипрамина, дезипрамина, амитриптилина, кломипрамина) и нейролептиков (галоперидола, дроперидола, тиоридазина, пимозида и др.), обладающих доказанным кардиотоксическим эффектом, так как они могут вызывать снижение АД, ухудшение течения СН и аритмии (класс рекомендаций III, уровень доказанности А) [219–223].
Термины и определения
Левожелудочковая недостаточность – состояние, обусловленное неспособностью ЛЖ переместить в аорту всю кровь, притекающую к нему из легочных вен, и характеризующееся застоем крови в малом круге кровообращения.
Правожелудочковая недостаточность – состояние, обусловленное снижением сократительной способности ПЖ, характеризуюется застоем в большом круге кровообращения.
Ортопноэ (orthopnoё от греч. orthos – «прямой» и рnоё – «дыхание») – высокая степень одышки с вынужденным (полусидячим или сидячим) положением больного.
Острый отек легких (кардиогенный отек легких) – острое состояние, в основе которого лежит острая левожелудочковая недостаточность, вследствие которой происходит патологическое накопление внесосудистой жидкости в легочной ткани и альвеолах, приводящее к снижению функциональных способностей легких.
Острая декомпенсированная СН – период течения ХСН, который характеризуется быстрым усугублением/появлением симптомов СН, что требует экстренной госпитализации пациента и проведения интенсивной терапии.
Ремоделирование сердца – процесс изменения структуры, формы и функции камер сердца, инициируемый утратой части жизнеспособного миокарда или повреждающей перегрузкой, который обеспечивает вначале адаптацию сердца к изменившимся условиям, а затем – его прогрессирующую функциональную неполноценность.
Сердечная астма – приступы одышки и удушья, возникающие из‑за застоя крови в легочных венах вследствие функциональной неполноценности левых отделов сердца.
Фракция выброса – показатель, представляющий собой отношение ударного объема крови ЛЖ к его конечно-диастолическому объему, выраженное в процентах.
Связанные документы
Порядок оказания медицинской помощи больным с ССЗ, утвержденный Приказом Минздрава России от 15 ноября 2012г. № 918н.
Порядок проведения диспансерного наблюдения, утвержденный приказом Минздрава России от 21 декабря 2012 года №1344н.
Приказ МЗ РФ от 23 марта 2012 года № 252‑н.
Информация для пациента
Основные симптомы СН: одышка при физической нагрузке или же ночная, в положении лежа, слабость, немотивированная усталость, учащенное сердцебиение, отеки нижних конечностей.
Диагноз «СН» ставит только врач – на основании клинических, инструментальных и лабораторных данных. Только врач дает рекомендации по диете, программе физической активности, медикаментозной поддержке и контролю за симптомами.
Лечение СН состоит из диеты, регулярной физической активности, медикаментозного лечения, мероприятий по изменению образа жизни. Все четыре компонента лечения одинаково важны для достижения результатов.
Диета
Хлорид натрия (поваренная соль) вызывает задержку жидкости в организме, повышает АД и нагрузку на сердце. Для определения количества натрия в продуктах следует использовать маркировку на упаковке. Дополнительные мероприятия по снижению количества поваренной соли в рационе: не держать солонку на столе и не досаливать пищу, ограничить употребление промышленно приготовленных блюд, включая консервированные и замороженные, минимизировать или совсем исключить из рациона колбасные изделия и копчености. Они не только содержат большое количество соли, но и большое количество животных жиров, которые повышают уровень ХС. Исключите из рациона домашние соленья. Пища должна быть легкоусвояемой, содержать большое количество зелени и овощей. Предпочтение среди животных белков следует отдавать птице и рыбе. Принимать пищу следует часто (4–5 раз в сутки) и небольшими порциями.
Контролируйте употребление алкоголя. В некоторых случаях врач порекомендует вам полный отказ от алкоголя, в других случаях допустимо эпизодическое употребление небольшого количества алкоголя, предпочтительно красное сухое вино – 1 бокал или кружку пива, или рюмку водки/коньяка.
Регулярные физические нагрузки
Регулярные физические нагрузки при СН дают много положительных эффектов: укрепляют сердечную мышцу, улучшают циркуляцию крови и позволяют утилизировать кислород крови более эффективно, уменьшают симптоматику СН, повышают выносливость, укрепляют мышечную и костную систему, позволяют снизить уровни стресса, тревожности и депрессии, улучшают сон. Уровень и типы нагрузок определяются лечащим врачом. Следует уточнить у лечащего врача возможность прохождения программы кардиореабилитации. Основной вид физической нагрузки при СН – это аэробные физические нагрузки: ходьба, занятия на велотренажере. Этот тип упражнений укрепляет сердце и легкие и улучшает способность организма использовать кислород. Перед началом аэробных упражнений и в конце занятия применяются упражнения для развития гибкости, которые включают медленное растягивание мышц и движения в суставах. Растяжка до и после тренировки помогает подготовить мышцы и предотвратить травмы и растяжения. Упражнения на гибкость могут включать растяжение, элементы китайской гимнастики (тай-чи) и йоги. Эти упражнения позволяют вам улучшить баланс, увеличить диапазон движений и сохранить суставы гибкими. Также применяются упражнения для тренировки дыхательных мышц. Эти упражнения помогают разработать межреберные мышцы и мышцы диафрагмы.
Общие правила выполнения упражнений
Программу тренировок должен одобрить лечащий врач. Не следует начинать тренироваться и/или вводить новый вид нагрузок, не посоветовавшись с кардиологом, а также специалистом в области лечебной физкультуры, если это возможно. Всегда перед началом занятий следует измерить частоту пульса и АД. Не приступайте к тренировкам при высоком АД (САД выше 160 мм рт. ст.), усилении одышки, частом и/или нерегулярном ритма сердца. Если произошел резкий набор веса (1–3 кг за последние 1–2 дня), то возможна задержка жидкости, такая ситуация требует обсуждения с лечащим врачом. Занятия на открытом воздухе проводятся только при комфортной температуре (на улице не должно быть слишком жарко, слишком холодно или влажно). При длительном перерыве в тренировках нужно начинать с более низкого уровня нагрузки и повышать ее интенсивность постепенно. Если назначен новый препарат, следует обсудить с врачом, как его назначение повлияет на переносимость физических нагрузок. Врач определяет максимально допустимую частоту пульса во время тренировки. Нормально ощущать чувство усталости в течение и после тренировок. Однако вы не должны при этом ощущать резкую слабость и головокружение. Следует немедленно прекратить тренировку в следующих случаях: боль, давление, жжение за грудиной, в левой руке или нижней челюсти, резкая слабость, головокружение, потемнение в глазах, любые других симптомы, вызывающие сильный дискомфорт.
Общие правила медикаментозного лечения
Не следует пропускать прием препаратов и самостоятельно вносить коррективы в схему лечения. Следует узнать у врача о побочных эффектах принимаемых вами лекарств, при возникновении аллергических реакций и побочных эффектов следует немедленно сообщить об этом лечащему врачу. При случайном пропуске дозы препарата следующая доза принимается в установленное время (никогда не следует принимать две дозы сразу). Полезно отмечать прием препаратов в дневнике. Удобно «привязать» прием препаратов к каким-либо регулярным повседневным действиям, например, чистке зубов или просмотру телевизионных новостей. Можно установить будильник или таймер на то время, когда нужно принимать лекарства.
Мероприятия по изменению образа жизни
Если есть повышенная масса тела, то ее снижение уменьшит нагрузку на сердце и сделает вас более подвижным и активным.
Всем пациентам, страдающим СН, следует отказаться от курения. Курение увеличивает риск развития повторных сердечных приступов и усиливает одышку, никотин учащает ритм сердца, вызывает спазм сосудов, что существенно затрудняет работу сердца.
У пациентов с СН жидкость может накапливаться в подкожно-жировой клетчатке и брюшной полости. Появление отеков говорит о том, что в состоянии наступили негативные изменения. При этом вес может увеличиваться очень быстро. Ежедневное взвешивание позволяет отследить негативные изменения для того, чтобы врач смог усилить терапию. Для того чтобы взвешивания были достоверными, следует взвешиваться каждое утро в одной и той же одежде, после мочеиспускания, перед едой, на одних и тех же весах. Результаты измерения записываются в календарь или дневник. В дневник также следует записывать цифры АД, пульс, названия лекарств, вес, все возникающие вопросы, какие-то заметные изменения в самочувствии. Увеличение/внезапное появление одышки, отеков или увеличения веса >2 кг в течение 3 дней говорит об ухудшении течения СН. Следует сообщить об этом лечащему врачу. Своевременная корректировка лечения позволит избежать обострения заболевания и повторных госпитализаций. Ведение дневника поможет сообщить больше информации на следующем приеме у лечащего врача.
Кроме полноценного ночного сна, следует отдыхать в середине дня и всякий раз при возникновении усталости.
Существует специальный обучающий сайт для паци- ентов и их близких с простой навигацией, множеством полезной информации, анимированными роликами. Адрес сайта – www.ossn.ru, вход для пациентов.
| № | Критерий | Уровни убедительности рекомендаций | Уровни достоверности доказательств |
|---|---|---|---|
1 |
Пациент состоит на диспансерном учете |
I |
C |
2 |
Назначены иАПФ (сартаны) или АРНИ при наличии показаний и отсутствии противопоказаний |
I |
A |
3 |
Назначены БАБ при наличии показаний и отсутствии противопоказаний |
I |
A |
4 |
Назначены АМКР при наличии показаний и отсутствии противопоказаний |
I |
A |
5 |
Назначены диуретики при наличии показаний и отсутствии противопоказаний |
I |
С |
6 |
ЧСС |
||
6.1 |
При недостижении уровня ЧСС 70 уд/мин у пациента с синусовым ритмом рекомендовано увеличение дозы БАБ или добавление ивабрадина |
I |
С |
6.2 |
При фибрилляции предсердий достигнута ЧСС менее 100 уд/мин |
I |
B |
7 |
Масса тела больного контролируется на визитах |
I |
C |
8 |
Не позднее 12 месяцев от момента оценки качества медицинской помощи выполнены и оценены в динамике: |
||
8.1 |
Измерение АД на каждом визите |
I |
C |
8.2 |
ЭКГ |
I |
C |
8.3 |
Трансторакальная ЭхоКГ |
I |
C |
8.4 |
Анализ крови клинический |
I |
C |
8.5 |
Анализ крови биохимический: калий, натрий, креатинин |
I |
C |
8.6 |
Расчет СКФ |
I |
C |
9 |
Проведена вакцинация против гриппа |
I |
C |
10 |
Проводится профилактика тромбоэмболических осложнений при наличии показаний и отсутствии противопоказаний |
I |
C |
11 |
Проведены беседы и даны рекомендации по коррекции ФР |
I |
C |
12 |
Направлен на консультацию врача-кардиолога при дестабилизации течения и рефрактерной к терапии ХСН, а также для оценки показаний к высокотехнологичной медицинской помощи (ИКД, СРТ и т.д.) |
I |
A |
| № | Критерий | Уровни убедительности рекомендаций | Уровни достоверности доказательств |
|---|---|---|---|
1 |
Тяжесть состояния, включая ЧСС, АД, ЧДД, оценена |
I |
C |
2 |
Определено насыщение крови кислородом |
I |
C |
3 |
Проведено рентгенологическое исследование органов грудной клетки в первые сутки госпитализации |
I |
C |
4 |
Проведены контрольные рентгенологические исследования при наличии показаний |
I |
C |
5 |
Проведены ЭхоКГ и контроль в случае необходимости |
I |
C |
6 |
Оценивается динамика массы тела в течение госпитализации |
I |
C |
7 |
Оценена динамика диуреза |
I |
C |
8 |
Анализ крови биохимический: калий, натрий, глюкоза, креатинин |
I |
C |
9 |
Назначены иАПФ (сартаны) при наличии показаний и отсутствии противопоказаний |
I |
A |
10 |
Назначены БАБ при наличии показаний и отсутствии противопоказаний |
I |
A |
11 |
Назначены АМКР при наличии показаний и отсутствии противопоказаний |
I |
A |
12 |
Назначены диуретики при наличии показаний и отсутствии противопоказаний |
I |
C |
13 |
Назначены сердечные гликозиды при наличии показаний и отсутствии противопоказаний |
IIa |
C |
14 |
Начата или продолжена терапия антикоагулянтами при наличии показаний |
I |
C |
15 |
Оценены показания к интервенционным (ИКД, СРТ, аритмологическим вмешательства) и хирургическим методам лечения |
I |
A |
16 |
При выписке |
||
16.1 |
Динамика ФК за время стационарного лечения оценена |
I |
C |
16.2 |
Даны рекомендации для врачей амбулаторного звена по титрации доз препаратов, если значения целевых показателей не достигнуты |
I |
C |
16.3 |
Даны рекомендации для врачей амбулаторного звена по дальнейшей тактике ведения пациента, включая использование методов высокотехнологичной медицинской помощи |
I |
C |
Приложение 1: Методология разработки клинических рекомендаций
Порядок обновления клинических рекомендаций
Рекомендации обновляются один раз в 3 года. Текст готовится рабочей группой. Обсуждение проекта рекомендаций осуществляется путем размещения на сайте www.ossn.ru. Утверждение текста рекомендаций происходит на ежегодных Конгрессах Ассоциированного члена Российского кардиологического общества (РКО) – Общества специалистов по СН «Сердечной недостаточности».
Целевая аудитория данных клинических рекомендаций
Уровни доказанности (достоверности данных) |
|
А |
Факты получены, по меньшей мере, из двух рандомизированных исследований |
B |
Факты получены из одного рандомизированного исследования или мета-анализа нерандомизированных исследований |
C |
Консолидированная позиция экспертов |
| Классы рекомендаций | ||
|---|---|---|
I |
Очевидные доказательства, что предлагаемое лечение/воздействие успешно, полезно и эффективно у всех больных |
Рекомендовано (всем больным) |
IIa |
Превалирует вес доказательств/точек зрения о пользе (эффективности) предлагаемого лечения/воздействия |
Применение ДОЛЖНО быть рассмотрено |
IIb |
Не очевидные доказательства о пользе (эффективности) предлагаемого лечения/воздействия |
Применение МОЖЕТ быть рассмотрено |
III |
Доказательства или общее соглашение, что лечение не полезно/неэффективно, а в некоторых случаях может быть вредно |
НЕ рекомендовано |
Список литературы
-
Фомин И.В. Хроническая сердечная недостаточность в Российской Федерации: что сегодня мы знаем и что должны делать. Российский кардиологический журнал. 2016; (8):7–13. DOI:10.15829/1560-4071-2016-8-7-13 [Fomin I.V. Xronicheskaya serdechnaya nedostatochnost` v Rossijskoj Federaczii: chto segodnya my` znaem i chto dolzhny` delat`. Rossijskij kardiologicheskij zhurnal. 2016; (8):7–13. DOI: 10.15829/1560-4071-2016-8-7-13].
-
Беленков Ю.Н., Фомин И.В., Мареев В.Ю., Агеев Ф.Т., Бадин Ю.В., Галявич А.С. и др. Распространенность хронической сердечной недостаточности в Европейской части Российской Федерации данные ЭПОХА–ХСН (часть 2). Журнал Сердечная Недостаточность. 2006;7 (3):3–7 [Belenkov Yu.N., Fomin I.V., Mareev V.Yu., Ageev F.T., Badin Yu.V., Galyavich A.S. i dr. Rasprostranennost` xronicheskoj serdechnoj nedostatochnosti v Evropejskoj chasti Rossijskoj Federaczii danny`e EPOXA–XSN (chast` 2). Zhurnal Serdechnaya Nedostatochnost`. 2006;7 (3):3–7].
-
Фомин И.В. Эпидемиология хронической сердечной недостаточности в Российской Федерации. В: Хроническая сердечная недостаточность. –М.: ГЭОТАР-Медиа; 2010. с.7–77 [Fomin I.V. E`pidemiologiya xronicheskoj serdechnoj nedostatochnosti v Rossijskoj Federaczii. V: Xronicheskaya serdechnaya nedostatochnost`. –M.: GE`OTAR-Media; 2010. s. 7–77].
-
Поляков Д.С., Фомин И.В., Валикулова Ф.Ю., Вайсберг А.Р., Краием Н., Бадин Ю.В. и др. Эпидемиологическая программа ЭПОХА–ХСН: декомпенсация хронической сердечной недостаточности в реальной клинической практике (ЭПОХА–Д–ХСН). Журнал Сердечная Недостаточность. 2016;17 (6):299–305. DOI: 10.18087/rhfj.2016.5.2239 [Polyakov D.S., Fomin I.V., Valikulova F.Yu., Vajsberg A.R., Kraiem N., Badin Yu.V. idr. E`pidemiologicheskaya programma E`POXA–XSN: dekompensacziya xronicheskoj serdechnoj nedostatochnosti v real`noj klinicheskoj praktike(E`POXA–D–XSN).ZhurnalSerdechnayaNedostatochnost`. 2016;17 (6):299–305. DOI: 10.18087/rhfj.2016.5.2239].
-
Козиолова Н.А., Никонова Ю.Н., Шилова Я.Э., Агафонов А.В., Полянская Е.А. Характеристика хронической сердечной недостаточности на фоне перманентной формы фибрилляции предсердий. Журнал Сердечная Недостаточность. 2013;14 (1):14–21. DOI: 10.18087/rhfj.2013.1.1806 [Koziolova N. A., Nikonova Yu.N., Shilova Ya. E`., Agafonov A.V., Polyanskaya E.A. Xarakteristika xronicheskoj serdechnoj nedostatochnosti na fone permanentnoj formy` fibrillyaczii predserdij. Zhurnal Serdechnaya Nedostatochnost`. 2013;14 (1):14–21. DOI: 10.18 087/rhfj.2013.1.1806].
-
Фомин И.В., Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т., Бадин Ю.В., Галявич А.С. и др. Распространенность хронической сердечной недостаточности в Европейской части Российской Федерации – данные ЭПОХА–ХСН. Журнал Сердечная Недостаточность. 2006;7 (3):112–5 [Fomin I.V., Belenkov Yu.N., Mareev V.Yu., Ageev F.T., Badin Yu.V., Galyavich A.S. i dr. Rasprostranennost` xronicheskoj serdechnoj nedostatochnosti v Evropejskoj chasti Rossijskoj Federaczii – danny`e EPOXA–XSN. Zhurnal Serdechnaya Nedostatochnost`. 2006;7 (3):112–5].
-
Артемьева Е.Г., Маленкова В.Ю., Фролова Е.В. Распростра ненность артериальной гипертензии при хронической сердечной недостаточности в Чувашской Республике. Медицинский альманах. 2011; (16):51–4 [Artem`eva E. G., Malenkova V.Yu., Frolova E.V. Rasprostranennost` arterial`noj gipertenzii pri xronicheskoj serdechnoj nedostatochnosti v Chuvashskoj Respublike. Mediczinskij al`manax. 2011; (16):51–4]
-
Сергеева Е.М., Малишевский М.В., Васина А.А., Мищенко Т.А., Кузьмина Ю.С., Раемгулов Р.А. Лечение хронической сердечной недостаточности в первичном звене муниципального здравоохранения в г. Тюмени. Медицинская наука и образование Урала. 2015;16 (4):32–4 [Sergeeva E.M., Malishevskij M.V., Vasina A.A., Mishhenko T.A., Kuz`mina Yu. S., Raemgulov R.A. Lechenie xronicheskoj serdechnoj nedostatochnosti v pervichnom zvene municzipal`nogo zdravooxraneniya v g.Tyumeni. Mediczinskaya nauka i obrazovanie Urala. 2015;16 (4):32–4].
-
Шакирова Р.М.,Галявич А.С.,Камалов Г.М.Распространенность сердечно-сосудистых заболеваний и сахарного диабета в респу- бликеТатарстаниихвзаимосвязьссимптомамихроническойсердечной недостаточности. Журнал Сердечная Недостаточность. 2005;6 (2):72–3 [Shakirova R.M., Galyavich A.S., Kamalov G.M. Rasprostranennost` serdechno-sosudisty`x zabolevanij i saxarnogo diabeta v respublike Tatarstan i ix vzaimosvyaz` s simptomami xronicheskoj serdechnoj nedostatochnosti. Zhurnal Serdechnaya Nedostatochnost`. 2005;6 (2):72–3].
-
Смирнова Е.А. Изучение распространенности и этиологии хронической сердечной недостаточности в Рязанской области. Российский кардиологический журнал. 2010; (2):78–83 [Smirnova E.A. Izuchenie rasprostranennosti i e`tiologii xronicheskoj serdechnoj nedostatochnosti v Ryazanskoj oblasti. Rossijskij kardiologicheskij zhurnal. 2010; (2):78–83].
-
Бабанская Е.Б., Меньшикова Л.В., Дац Л.С. Эпидемио логия хронической сердечной недостаточности в городе Иркутске. Бюллетень ВСНЦ СО РАМН. 2012; (5–1):25–8 [Babanskaya E.B., Men`shikova L. V., Dacz L.S. E`pidemiologiya xronicheskoj serdechnoj nedostatochnosti v gorode irkutske. Byulleten` VSNCz SO RAMN. 2012; (5–1):25–8].
-
Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т., Фомин И.В., Бадин Ю.В., Поляков Д.С. и др. Истинная распространенность ХСН в Европейской части Российской Федерации (исследование ЭПОХА, госпитальный этап). Журнал Сердечная Недостаточность. 2011;12 (2):63–8 [Belenkov Yu.N., Mareev V.Yu., Ageev F.T., Fomin I.V., Badin Yu.V., Polyakov D.S. i dr. Istinnaya rasprostranennost` XSN v Evropejskoj chasti Rossijskoj Federaczii (issledovanie E`POXA, gospital`ny`j e`tap). Zhurnal Serdechnaya Nedostatochnost`. 2011;12 (2):63–8].
-
Беленков Ю.Н., Фомин И.В., Мареев В.Ю., Агеев Ф.Т., Бадин Ю.В., Галявич А.С. и др. Распространенность хронической сердечной недостаточности в Европейской части Российской Федерации данные ЭПОХА–ХСН (часть 2). Журнал Сердечная Недостаточность. 2006;7 (3):3–7 [Belenkov Yu.N., Fomin I.V., Mareev V.Yu., Ageev F.T., Badin Yu.V., Galyavich A.S. i dr. Rasprostranennost` xronicheskoj serdechnoj nedostatochnosti v Evropejskoj chasti Rossijskoj Federaczii danny`e EPOXA–XSN (chast` 2). Zhurnal Serdechnaya Nedostatochnost`. 2006;7 (3):3–7]
-
Фомин И.В., Бадин Ю.В., Поляков Д.С., Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т. и др. Предгипертония: как часто встречается данное состояние сердечно-сосудистой системы у граждан Европейской части России (данные исследования ЭПОХА–АГ, 2002–2007гг.). Современные технологии в медицине. 2013;5 (2):38–46 [Fomin I.V., Badin Yu.V., Polyakov D.S., Belenkov Yu.N., Mareev V.Yu., Ageev F.T. i dr. Predgipertoniya: kak chasto vstrechaetsya dannoe sostoyanie serdechno-sosudistoj sistemy` u grazhdan Evropejskoj chasti Rossii (danny`e issledovaniya E`POXA–AG, 2002–2007gg.). Sovremenny`e texnologii v mediczine. 2013;5 (2):38–46].
-
Fuat A, Murphy JJ, Hungin APS, Curry J, Mehrzad AA, Hetherington A etal. The diagnostic accuracy and utility of a B-type natriuretic peptide test in a community population of patients with suspected heart failure. Br J Gen Pract. 2006;56 (526):327–33.
-
Yamamoto K, Burnett JC, Bermudez EA, Jougasaki M, Bailey KR, Redfield MM. Clinical criteria and biochemical markers for the detection of systolic dysfunction. Journal of Cardiac Failure. 2000;6 (3):194–200. DOI: 10.1054/jcaf.2000.9676.
-
Cowie MR, Struthers AD, Wood DA, Coats AJ, Thompson SG, Poole-Wilson PA etal. Value of natriuretic peptides in assessment of patients with possible new heart failure in primary care. The Lancet. 1997;350 (9088):1349–53. DOI: 10.1016/S0140– 6736 (97) 06031–5.
-
Krishnaswamy P, Lubien E, Clopton P, Koon J, Kazanegra R, Wanner E etal. Utility of B-natriuretic peptide levels in identifying patients with left ventricular systolic or diastolic dysfunction. Am JMed. 2001;111 (4):274–9.
-
Kelder JC, Cowie MR, McDonagh TA, Hardman SMC, Grobbee DE, Cost B etal. Quantifying the added value of BNP in suspected heart failure in general practice: an individual patient data meta-analysis. Heart. 2011;97 (12):959–63. DOI: 10.1136/hrt.2010.220426.
-
Kelder JC, Cramer MJ, Verweij WM, Grobbee DE, Hoes AW. Clinical Utility of Three B-Type Natriuretic Peptide Assays for the Initial Diagnostic Assessment of New Slow-Onset Heart Failure. Journal of Cardiac Failure. 2011;17 (9):729–34. DOI: 10.1016/j. cardfail.2011.04.013.
-
Gustafsson F, Steensgaard-Hansen F, Badskjaer J, Poulsen AH, Corell P, Hildebrandt P. Diagnostic and prognostic performance of N-terminal ProBNP in primary care patients with suspected heart failure. J Card Fail. 2005;11 (5 Suppl): S15–20.
-
Nielsen OW, Rasmussen V, Christensen NJ, Hansen JF. Neuro endocrine testing in community patients with heart disease: plasma N-terminal proatrial natriuretic peptide predicts morbidity and mortality stronger than catecholamines and heart rate variability. Scandinavian Journal of Clinical and Laboratory Investigation. 2004;64 (7):619–28. DOI: 10.1080/00365510410002878.
-
Sicari R, Nihoyannopoulos P, Evangelista A, Kasprzak J, Lancellotti P, Poldermans D etal. Stress Echocardiography Expert Consensus Statement – Executive Summary: European Association of Echocardiography (EAE) (a registered branch of the ESC). European Heart Journal. 2008;30 (3):278–89. DOI: 10.1093/eurheartj/ehn492.
-
Beller GA, Heede RC. SPECT Imaging for Detecting Coronary Artery Disease and Determining Prognosis by Noninvasive Assessment of Myocardial Perfusion and Myocardial Viability. Journal of Cardiovascular Translational Research. 2011;4 (4):416– 24. DOI: 10.1007/s12265‑011‑9290‑2.
-
Sheikine Y, Di Carli MF. Integrated PET/CT in the assessment of etiology and viability in ischemic heart failure. Curr Heart Fail Rep. 2008;5 (3):136–42
-
Beanlands RSB, Nichol G, Huszti E, Humen D, Racine N, Freeman M etal. F-18‑Fluorodeoxyglucose Positron Emission Tomography Imaging-Assisted Management of Patients With Severe Left Ventricular Dysfunction and Suspected Coronary Disease. Journal of the American College of Cardiology. 2007;50 (20):2002–12. DOI: 10.1016/j.jacc.2007.09.006.
-
Allman KC, Shaw LJ, Hachamovitch R, Udelson JE. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol. 2002;39 (7):1151–8.
-
Ling LF, Marwick TH, Flores DR, Jaber WA, Brunken RC, Cerqueira MD etal. Identification of Therapeutic Benefit from Revascularization in Patients With Left Ventricular Systolic Dysfunction: Inducible Ischemia Versus Hibernating Myocardium. Circulation: Cardiovascular Imaging. 2013;6 (3):363–72. DOI: 10. 1161/CIRCIMAGING.112.000138.
-
Bonow RO, Maurer G, Lee KL, Holly TA, Binkley PF, DesvigneNickens P etal. Myocardial Viability and Survival in Ischemic Left Ventricular Dysfunction. New England Journal of Medicine. 2011;364 (17):1617–25. DOI: 10.1056/NEJMoa1100358.
-
Arena R, Myers J, Guazzi M. Cardiopulmonary Exercise Testing Is a Core Assessment for Patients With Heart Failure. Congestive Heart Failure. 2011;17 (3):115–9. DOI:10.1111/j.1751– 7133.2011.00216.
-
Мареев Ю.В., Герасимова В.В., Горюнова Т.В., Петрухина А.А., Даниелян М.О., Капанадзе Л.Г. и др. Факторы, определяющие прогноз при хронической сердечной недостаточности: роль ширины иморфологиикомплексаQRS.ЖурналСердечнаяНедостаточность. 2012;13(5):255–66[MareevYu.V.,GerasimovaV.V.,GoryunovaT.V., Petruxina A.A., Danielyan M.O., Kapanadze L.G. i dr. Faktory`, opre- delyayushhie prognoz pri xronicheskoj serdechnoj nedostatochnosti: rol` shiriny` i morfologii kompleksa QRS. Zhurnal Serdechnaya Nedostatochnost`. 2012;13 (5):255–66].
-
Bergström A, Andersson B, Edner M, Nylander E, Persson H, Dahlström U. Effect of carvedilol on diastolic function in patients with diastolic heart failure and preserved systolic function. Results of the Swedish Doppler-echocardiographic study (SWEDIC). European Journal of Heart Failure. 2004;6 (4):453–61. DOI: 10.1016/j.ejheart.2004.02.003.
-
Flather MD. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). European Heart Journal. 2004;26 (3):215–25. DOI: 10.1093/eurheartj/ehi115.
-
Беленков Ю.Н., Мареев В.Ю. Лечение сердечной недостаточности в XXI веке: достижения, вопросы и уроки доказательной медицины. Кардиология. 2008;48 (2):6–16 [Belenkov Yu.N., Mareev V.Yu. Lechenie serdechnoj nedostatochnosti v XXIveke: dostizheniya, voprosy` i uroki dokazatel`noj medicziny`. Kardiologiya. 2008;48 (2):6–16].
-
Rathore SS, Curtis JP, Wang Y, Bristow MR, Krumholz HM. Association of serum digoxin concentration and outcomes in patients with heart failure. JAMA. 2003;289 (7):871–8.
-
Gheorghiade M, Patel K, Filippatos G, Anker SD, van Veldhuisen DJ, Cleland JGF etal. Effect of oral digoxin in high-risk heart fai lure patients: a pre-specified subgroup analysis of the DIG trial. European Journal of Heart Failure. 2013;15 (5):551–9. DOI: 10.1093/eurjhf/hft010.
-
Packer M, Carson P, Elkayam U, Konstam MA, Moe G, O’Connor C etal. Effect of Amlodipine on the Survival of Patients With Severe Chronic Heart Failure Due to a Nonischemic Cardiomyopathy. JACC: Heart Failure. 2013;1 (4):308–14. DOI: 10.1016/j. jchf.2013.04.004.
-
Cohn JN, Ziesche S, Smith R, Anand I, Dunkman WB, Loeb H etal. Effect of the calcium antagonist felodipine as supplementary vaso- dilator therapy in patients with chronic heart failure treated with enalapril: V-HeFT III. Vasodilator-Heart Failure Trial (V-HeFT) Study Group. Circulation. 1997;96 (3):856–63.
-
Anker SD, Colet JC, Filippatos G, Willenheimer R, Dickstein K, Drexler H etal. Rationale and design of Ferinject® Assessment in patients with IRon deficiency and chronic Heart Failure (FAIRHF) study: a randomized, placebo-controlled study of intravenous iron supplementation in patients with and without anaemia. European Journal of Heart Failure. 2009;11 (11):1084–91. DOI: 10.1093/eurjhf/hfp140.
-
Ponikowski P, van Veldhuisen DJ, Comin-Colet J, Ertl G, Komajda M, MareevV etal. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. European Heart Journal. 2015;36 (11):657–68. DOI: 10.1093/eurheartj/ehu385.
-
Kjekshus J, Apetrei E, Barrios V, Böhm M, Cleland JGF, Cornel JH etal. Rosuvastatin in Older Patients with Systolic Heart Failure. New England Journal of Medicine. 2007;357 (22):2248–61. DOI: 10.1056/NEJMoa0706201.
-
Wang J-Q, Wu G-R, Wang Z, Dai X-P, Li X-R. Long-term Clinical Outcomes of Statin Use for Chronic Heart Failure: A Meta-analysis of 15 Prospective Studies. Heart, Lung and Circulation. 2014;23 (2):105–13. DOI: 10.1016/j.hlc.2013.07.012.
-
Fotino AD, Thompson-Paul AM, Bazzano LA. Effect of coenzyme Q10 supplementation on heart failure: a meta-analysis. American Journal of Clinical Nutrition. 2013;97 (2):268–75. DOI: 10.3945/ajcn.112.040741.
-
Мареев В.Ю., Минина Ю.В., Беграмбекова Ю.Л. КУДЕсан® (капли 3% для приема внутрь) в лечении больных Сердечной Недостаточностью: эффективность И без- опасность в Комбинации со стандартной терапией (КУДЕСНИК). Дизайн и результаты проспективного рандомизированного двойного слепого исследования КУДЕСНИК. Журнал Сердечная Недостаточность. 2016;17 (4):236–49. DOI:10.18087/rhfj.2016.4.2257 [Mareev V.Yu., Minina Yu.V., Begrambekova Yu.L. KUDEsan® (kapli 3% dlya priema vnutr`) v lechenii bol`ny`x Serdechnoj Nedostatochnost`yu: effektivnost`Ibezopasnost`vKombinaczii so standartnoj terapiej (KUDESNIK). Dizajn i rezul`taty` prospektivnogo randomizirovannogo dvojnogo slepogo issledovaniya KUDESNIK. Zhurnal Serdechnaya Nedostatochnost`. 2016;17 (4):236–49. DOI: 10.18087/rhfj.2016.4.2257].
-
Mortensen SA, Rosenfeldt F, Kumar A, Dolliner P, Filipiak KJ, Pella D etal. The Effect of Coenzyme Q10 on Morbidity and Mortality in Chronic Heart Failure. JACC: Heart Failure. 2014;2 (6):641–9. DOI: 10.1016/j.jchf.2014.06.008.
-
Velazquez EJ, Lee KL, Deja MA, Jain A, Sopko G, Marchenko A etal. Coronary-Artery Bypass Surgery in Patients with Left Ventricular Dysfunction. New England Journal of Medicine. 2011;364 (17):1607–16. DOI: 10.1056/NEJMoa1100356.
-
Bangalore S, Pursnani S, Kumar S, Bagos PG. Percutaneous Coronary Intervention Versus Optimal Medical Therapy for Prevention of Spontaneous Myocardial Infarction in Subjects With Stable Ischemic Heart Disease. Circulation. 2013;127 (7):769–81. DOI: 10.1161/CIRCULATIONAHA.112.131961.
-
Trikalinos TA, Alsheikh-Ali AA, Tatsioni A, Nallamothu BK, Kent DM. Percutaneous coronary interventions for non-acute coronary artery disease: a quantitative 20‑year synopsis and a network meta-analysis. The Lancet. 2009;373 (9667):911–8. DOI: 10.1016/S0140–6736 (09) 60319–6.
-
Velazquez EJ, Lee KL, Jones RH, Al-Khalidi HR, Hill JA, Panza JA etal. Coronary-Artery Bypass Surgery in Patients with Ischemic Cardiomyopathy. New England Journal of Medicine. 2016;374 (16):1511–20. DOI: 10.1056/NEJMoa1602001.
-
Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS etal. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Heart Journal. 2016;37 (27):2129–200. DOI: 10.1093/eurheartj/ehw128
-
Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP, Guyton RA etal. 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease. Journal of the American College of Cardiology. 2014;63 (22):e57–185. DOI: 10.1016/j. jacc.2014.02.536.
-
Latib A, Giannini A. Cardiac Interventions Today – The Next Frontier of Percutaneous Tricuspid Valve Repair. Cardiac Interventions Today. 2016;10 (4):54–9.
-
Rose EA, Gelijns AC, Moskowitz AJ, Heitjan DF, Stevenson LW, DembitskyWetal.Long-TermUseofaLeftVentricularAssistDevice for End-Stage Heart Failure. New England Journal of Medicine. 2001;345 (20):1435–43. DOI: 10.1056/NEJMoa012175.
-
SlaughterMS,RogersJG,MilanoCA,RussellSD,ConteJV,FeldmanD etal. Advanced Heart Failure Treated with Continuous-Flow Left Ventricular Assist Device. New England Journal of Medicine. 2009;361 (23):2241–51. DOI: 10.1056/NEJMoa0909938.
-
Estep JD, Starling RC, Horstmanshof DA, Milano CA, Selzman CH, Shah KB etal. Risk Assessment and Comparative Effectiveness of Left Ventricular Assist Device and Medical Management in Ambulatory Heart Failure Patients. Journal of the American College of Cardiology. 2015;66 (16):1747–61. DOI: 10.1016/j. jacc.2015.07.075.
-
Sipahi I, Chou JC, Hyden M, Rowland DY, Simon DI, Fang JC. Effect of QRS morphology on clinical event reduction with cardiac resynchronization therapy: Meta-analysis of randomized controlled trials. American Heart Journal. 2012;163 (2):260–267.e3. DOI: 10.1016/j.ahj.2011.11.014.
-
Cleland JG, Abraham WT, Linde C, Gold MR, Young JB, Claude DaubertJ etal. An individual patient meta-analysis of five randomized trials assessing the effects of cardiac resynchronization therapy on morbidity and mortality in patients with symptomatic heart failure. European Heart Journal. 2013;34 (46):3547–56. DOI: 10.1093/eurheartj/eht290.
-
Kang S-H, Oh I-Y, Kang D-Y, Cha M-J, Cho Y, Choi E-K etal. Cardiac Resynchronization Therapy and QRS Duration: Systematic Review, Meta-analysis, and Meta-regression. Journal of Korean Medical Science. 2015;30 (1):24. DOI: 10.3346/jkms.2015.30.1.24.
-
Birnie DH, Ha A, Higginson L, Sidhu K, Green M, Philippon F etal. Impact of QRS Morphology and Duration on Outcomes After Cardiac Resynchronization Therapy: Results From the Resynchronization-Defibrillation for Ambulatory Heart Failure Trial (RAFT). Circulation: Heart Failure. 2013;6 (6):1190–8. DOI :10.1161/CIRCHEARTFAILURE.113.000380.
-
Gasparini M, Auricchio A, Metra M, Regoli F, Fantoni C, Lamp B etal. Long-term survival in patients undergoing cardiac resynchronization therapy: the importance of performing atrioventricular junction ablation in patients with permanent atrial fibrillation. European Heart Journal. 2008;29 (13):1644–52. DOI: 10.1093/eurheartj/ehn133.
-
Gasparini M, Leclercq C, Lunati M, Landolina M, Auricchio A, SantiniM etal. Cardiac Resynchronization Therapy in Patients With Atrial Fibrillation. JACC: Heart Failure. 2013;1 (6):500–7. DOI: 10.1016/j.jchf.2013.06.003.
-
Delnoy PPHM, Ottervanger JP, Luttikhuis HO, Elvan A, Misier ARR, Beukema WP etal. Comparison of Usefulness of Cardiac Resynchronization Therapy in Patients With Atrial Fibrillation and Heart Failure Versus Patients With Sinus Rhythm and Heart Failure. The American Journal of Cardiology. 2007;99 (9):1252–7. DOI: 10.1016/j.amjcard.2006.12.040.
-
Healey JS, Hohnloser SH, Exner DV, Birnie DH, Parkash R, ConnollySJ etal. Cardiac Resynchronization Therapy in Patients With Permanent Atrial Fibrillation: Results From the Resynchro nization for Ambulatory Heart Failure Trial (RAFT). Circulation: Heart Failure. 2012;5 (5):566–70. DOI: 10.1161/CIRCHEARTF AILURE.112.968867.
-
BeshaiJF,GrimmRA,NaguehSF,BakerJH,BeauSL,GreenbergSM etal. Cardiac-Resynchronization Therapy in Heart Failure with Narrow QRS Complexes. New England Journal of Medicine. 2007;357 (24):2461–71. DOI: 10.1056/NEJMoa0706695.
-
on behalf of the ESTEEM–CRT Investigators, Donahue T, Niazi I, Leon A, Stucky M, Herrmann K. Acute and Chronic Response to CRT in Narrow QRS Patients. Journal of Cardiovascular Translational Research. 2012;5 (2):232–41. DOI: 10.1007/s1226 5‑011‑9338‑3.
-
Thibault B, Harel F, Ducharme A, White M, Ellenbogen KA, Frasure- Smith N etal. Cardiac Resynchronization Therapy in Patients With Heart Failure and a QRS Complex <120 Milliseconds: The Evaluation of Resynchronization Therapy for Heart Failure (LESSER-EARTH) Trial. Circulation. 2013;127 (8):873–81. DOI :10.1161/CIRCULATIONAHA.112.001239.
-
Steffel J, Robertson M, Singh JP, Abraham WT, Bax JJ, Borer JS etal. The effect of QRS duration on cardiac resynchronization therapy in patients with a narrow QRS complex: a subgroup analysis of the EchoCRT trial. European Heart Journal. 2015;36 (30):1983–9. DOI: 10.1093/eurheartj/ehv242.
-
Connolly S. Meta-analysis of the implantable cardioverter defibril- lator secondary prevention trials. European Heart Journal. 2000;21 (24):2071–8. DOI: 10.1053/euhj.2000.2476.
-
Moss AJ, Zareba W, Hall WJ, Klein H, Wilber DJ, Cannom DS etal. Prophylactic Implantation of a Defibrillator in Patients with Myocardial Infarction and Reduced Ejection Fraction. New England Journal of Medicine. 2002;346 (12):877–83. DOI: 10.1056/NEJMoa013474.
-
Bardy GH, Lee KL, Mark DB, Poole JE, Packer DL, Boineau R etal. Amiodarone or an Implantable Cardioverter–Defibrillator for Congestive Heart Failure. New England Journal of Medicine. 2005;352 (3):225–37. DOI: 10.1056/NEJMoa043399.
-
Desai AS, Fang JC, Maisel WH, Baughman KL. Implantable Defibrillators for the Prevention of Mortality in Patients With Nonischemic Cardiomyopathy: A Meta-analysis of Randomized Controlled Trials. JAMA. 2004;292 (23):2874. DOI: 10.1001/jama.292.23.2874.
-
Anker SD, Ponikowski P, Varney S, Chua TP, Clark AL, WebbPeploe KM etal. Wasting as independent risk factor for mortality in chronic heart failure. The Lancet. 1997;349 (9058):1050–3. DOI: 10.1016/S0140–6736 (96) 07015–8.
-
Anker SD, Coats AJ. Cachexia in heart failure is bad for you. Eur Heart J. 1998;19 (2):191–3.
-
Pasini E, Aquilani R, Gheorghiade M, Dioguardi FS. Malnutrition, muscle wasting and cachexia in chronic heart failure: the nutritio nal approach. Ital Heart J. 2003;4 (4):232–5.
-
Heymsfield SB, Casper K. Congestive heart failure: clinical mana gement by use of continuous nasoenteric feeding. Am J Clin Nutr. 1989;50 (3):539–44
-
Paccagnella A, Calò MA, Caenaro G, Salandin V, Jus P, Simini G etal. Cardiac cachexia: preoperative and postoperative nutrition management. JPEN J Parenter Enteral Nutr. 1994;18 (5):409–16.
-
Шестопалов А.Е., Матраева Ю.С., Дьяков А.Ю., Кожемяка И.В., Кудряшов С.К., Чернов М.Ю. Нутритивная поддержка и коррекция метаболических нарушений у больных с ишемической болезнью сердца и дефицитом тощей массы тела при хирургической реваскуляризации миокарда. Сердечная недостаточность. 2001;2 (3):108–12 [Shestopalov A.E., Matraeva Yu.S., D`yakovA.Yu.,KozhemyakaI.V.,KudryashovS.K.,ChernovM.Yu. Nutritivnaya podderzhka i korrekcziya metabolicheskix narushenij u bol`ny`x s ishemicheskoj bolezn`yu serdcza i deficzitom toshhej massy` tela pri xirurgicheskoj revaskulyarizaczii miokarda. Serdechnaya nedostatochnost`. 2001;2 (3):108–12].
-
Арутюнов Г.П., Костюкевич О.И. Питание больных с хронической сердечной недостаточностью, проблемы нутритивной поддержки, решенные и нерешенные аспекты. Журнал Сердечная Недостаточность. 2002;3 (5):245–8 [Arutyunov G.P., Kostyukevich O.I. Pitanie bol`ny`x s xronicheskoj serdechnoj nedostatochnost`yu, problemy` nutritivnoj podderzhki, reshenny`e i nereshenny`e aspekty`. Zhurnal Serdechnaya Nedostatochnost`. 2002;3 (5):245–8].
-
Walsh CR, Larson MG, Evans JC, Djousse L, Ellison RC, Vasan RS etal. Alcohol consumption and risk for congestive heart fai lure in the Framingham Heart Study. Ann Intern Med. 2002;136 (3):181–91.
-
Abramson JL, Williams SA, Krumholz HM, Vaccarino V. Moderate alcohol consumption and risk of heart failure among older persons. JAMA. 2001;285 (15):1971–7.
-
Køber L, Thune JJ, Nielsen JC, Haarbo J, Videbæk L, Korup E etal. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. New England Journal of Medicine. 2016;375 (13):1221–30. DOI: 10.1056/NEJMoa1608029.
-
Sullivan MJ, Higginbotham MB, Cobb FR. Exercise training in patients with chronic heart failure delays ventilatory anaerobic threshold and improves submaximal exercise performance. Circulation. 1989;79 (2):324–9. DOI: 10.1161/01. CIR.79.2.324.
-
Smart N, Marwick TH. Exercise training for patients with heart fail- ure: a systematic review of factors that improve mortality and mor- bidity. The American Journal of Medicine. 2004;116 (10):693–706. DOI: 10.1016/j.amjmed.2003.11.033.
-
Exercise training meta-analysis of trials in patients with chronic heart failure (ExTraMATCH). BMJ. 2004;328 (7433):189–0. DOI: 10.1136/bmj.37938.645220. EE.
-
Isnard R, Pousset F, Trochu J-N, Chafirovskaïa O, Carayon A, Golmard J-L etal. Prognostic value of neurohormonal activation and cardiopulmonary exercise testing in patients with chronic heart failure. The American Journal of Cardiology. 2000;86 (4):417–21. DOI: 10.1016/S0002–9149 (00) 00957–7.
-
Guazzi M, Adams V, Conraads V, Halle M, Mezzani A, Vanhees L etal. Clinical Recommendations for Cardiopulmonary Exercise Testing Data Assessment in Specific Patient Populations. Circulation. 2012;126 (18):2261–74. DOI: 10.1161/CIR.0b013e 31826fb946.
-
Арутюнов Г.П. Вопросы немедикаментозного лечения пациентов, страдающих сердечной недостаточностью. Сердечная недостаточность. 2001;2 (1):35–6 [Arutyunov G.P. Voprosy` nemedikamentoznogo lecheniya paczientov, stradayushhix serdechnoj nedostatochnost`yu. Serdechnaya nedostatochnost`. 2001;2 (1):35–6].
-
Осипова И.В. «Свободный выбор нагрузки» физических тренировок – эффективный метод лечения хронической сердечной недостаточности. Сердечная недостаточность. 2001;2 (4):176–80 [Osipova I.V. «Svobodny`j vy`bor nagruzki» fizicheskix trenirovok – e`ffektivny`j metod lecheniya xronicheskoj serdechnoj nedostatochnosti. Serdechnaya nedostatochnost`. 2001;2 (4):176–80].
-
Оганов Р.Г., Кухарчук В.В., Арутюнов Г.П., Галявич А.С., Гуревич В.С., Дупляков Д.В. и др. Сохраняющиеся нарушения показателей липидного спектра у пациентов с дислипидемией, получающих статины, в реальной клинической практике в Российской Федерации (российская часть исследования DYSIS). Кардиоваскулярная терапия и профилактика. 2012;11 (4):70–8 [Oganov R.G., Kuxarchuk V.V., Arutyunov G.P., Galyavich A.S., Gurevich V.S., Duplyakov D.V. idr. Soxranya yushhiesya narusheniya pokazatelej lipidnogo spektra u paczientov s dislipidemiej, poluchayushhix statiny`, v real`noj klinicheskoj praktike v Rossijskoj Federaczii (rossijskaya chast` issledovaniya DYSIS). Kardiovaskulyarnaya terapiya i profilaktika. 2012;11 (4):70–8].
-
Kjekshus J, Pedersen TR, Olsson AG, Faergeman O, Pyörälä K. The effects of simvastatin on the incidence of heart failure in patients with coronary heart disease. J Card Fail. 1997;3 (4):249–54.
-
Lewis SJ, Moye LA, Sacks FM, Johnstone DE, Timmis G, Mitchell J etal. Effect of pravastatin on cardiovascular events in older patients with myocardial infarction and cholesterol levels in the average range. Results of the Cholesterol and Recurrent Events (CARE) trial. Ann Intern Med. 1998;129 (9):681–9.
-
Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. N Engl J Med. 1998;339 (19):1349–57. DOI: 10.1056/NEJM199811053391902.
-
The Norwegian Multicenter Study Group. Timolol-Induced Reduction in Mortality and Reinfarction in Patients Surviving Acute Myocardial Infarction. New England Journal of Medicine. 1981;304 (14):801–7. DOI: 10.1056/NEJM198104023041401.
-
Chadda K, Goldstein S, Byington R, Curb JD. Effect of propranolol after acute myocardial infarction in patients with congestive heart failure. Circulation. 1986;73 (3):503–10.
-
Pfeffer MA, Braunwald E, Moyé LA, Basta L, Brown EJ, Cuddy TE etal. Effect of Captopril on Mortality and Morbidity in Patients with Left Ventricular Dysfunction after Myocardial Infarction: Results of the Survival and Ventricular Enlargement Trial. New England Journal of Medicine. 1992;327 (10):669–77. DOI: 10.10 56/NEJM199209033271001.
-
GISSI-3: effects of lisinopril and transdermal glyceryl trinitrate singly and together on 6‑week mortality and ventricular function after acute myocardial infarction. Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Miocardico. Lancet. 1994;343 (8906):1115–22.
-
ISIS-4: a randomised factorial trial assessing early oral captopril, oral mononitrate, and intravenous magnesium sulphate in 58,050 patients with suspected acute myocardial infarction. ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group. Lancet. 1995;345 (8951):669–85.
-
Pfeffer MA, McMurray JJV, Velazquez EJ, Rouleau J-L, Køber L, Maggioni AP etal. Valsartan, Captopril, or Both in Myocardial Infarction Complicated by Heart Failure, Left Ventricular Dysfunction, or Both. New England Journal of Medicine. 2003;349 (20):1893–906. DOI: 10.1056/NEJMoa032292.
-
Pitt B, Remme W, Zannad F, Neaton J, Martinez F, Roniker B etal. Eplerenone, a Selective Aldosterone Blocker, in Patients with Left Ventricular Dysfunction after Myocardial Infarction. New England Journal of Medicine. 2003;348 (14):1309–21. DOI: 10.1056/NEJMoa030207.
-
Vantrimpont P, Rouleau JL, Wun C–C, Ciampi A, Klein M, Sussex B etal. Additive Beneficial Effects of Beta-Blockers to Angiotensin- Converting Enzyme Inhibitors in the Survival and Ventricular Enlargement (SAVE) Study. Journal of the American College of Cardiology. 1997;29 (2):229–36. DOI: 10.1016/S0735– 1097(96)00489–5.
-
Levy D, Larson MG, Vasan RS, Kannel WB, Ho KK. The progression from hypertension to congestive heart failure. JAMA. 1996;275 (20):1557–62
-
Мареев В.Ю., Беленков Ю.Н. Хроническая сердечная недостаточность и инсулиннезависимый сахарный диабет случайная связь или закономерность. Терапевтический архив. 2003;75 (10):1–10 [Mareev V.Yu., Belenkov Yu.N. Xronicheskaya serdechnaya nedostatochnost` i insulinnezavisimy`j saxarny`j diabet sluchajnaya svyaz` ili zakonomernost`. Terapevticheskij arxiv. 2003;75 (10):1–10].
-
Ильина А.В., Мареев В.Ю., Герасимова В.В., Джахангиров Т.Ш., Беленков Ю.Н. Эффективность терапии иАПФ фозиноприлом больных с ХСН в сочетании с СД 2 типа (по материалам исследования ФАСОН). Журнал Сердечная Недостаточность. 2005;6 (5):181–5 [Il`ina A. V., Mareev V.Yu., Gerasimova V.V., Dzhaxangirov T.Sh., Belenkov Yu.N. E`ffektivnost` terapii iAPF fozinoprilom bol`ny`x s XSN v sochetanii s SD 2 tipa (po materialam issledovaniya FASON). Zhurnal Serdechnaya Nedostatochnost`. 2005;6 (5):181–5].
-
Krumholz HM, Chen YT, Wang Y, Vaccarino V, Radford MJ, Horwitz RI. Predictors of readmission among elderly survivors of admission with heart failure. Am Heart J. 2000;139 (1 Pt 1):72–7.
-
Shindler DM, Kostis JB, Yusuf S, Quinones MA, Pitt B, Stewart D etal. Diabetes mellitus, a predictor of morbidity and mortality in the Studies of Left Ventricular Dysfunction (SOLVD) Trials and Registry. Am J Cardiol. 1996;77 (11):1017–20.
-
Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. UK Prospective Diabetes Study Group. BMJ. 1998;317 (7160):703–13.
-
Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The Effect of Angiotensin-Converting-Enzyme Inhibition on Diabetic Nephropathy. New England Journal of Medicine. 1993;329 (20):1456–62. DOI: 10.1056/NEJM199311113292004.
-
Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICRO-HOPE substudy. Heart Outcomes Prevention Evaluation Study Investigators. Lancet. 2000;355 (9200):253–9.
-
Brenner BM, Cooper ME, de Zeeuw D, Keane WF, Mitch WE, Parving H-H etal. Effects of Losartan on Renal and Cardiovascular Outcomes in Patients with Type 2 Diabetes and Nephropathy. New England Journal of Medicine. 2001;345 (12):861–9. DOI: 10.1056/NEJMoa011161.
-
Berl T, Hunsicker LG, Lewis JB, Pfeffer MA, Porush JG, Rouleau J-L etal. Cardiovascular outcomes in the Irbesartan Diabetic Nephropathy Trial of patients with type 2 diabetes and overt nephropathy. Ann Intern Med. 2003;138 (7):542–9.
-
Savard LA, Thompson DR, Clark AM. A meta-review of evidence on heart failure disease management programs: the challenges of describing and synthesizing evidence on complex interventions. Trials. 2011;12 (1). DOI: 10.1186/1745‑6215‑12‑194.
-
Мареев В.Ю., Беграмбекова Ю.Л., Даниелян М.О., Агеев Ф.Т., Гиляревский С.Р., Беленков Ю.Н. и др. Какие вопросы задаются и на какие вопросы способны ответить исследования по немедикаментозному лечению пациентов с сердечной недостаточностью. Уроки исследования ШАНС. Журнал Сердечная Недостаточность. 2014;15 (6):383–96 [Mareev V.Yu., BegrambekovaYu.L.,DanielyanM.O.,AgeevF.T.,GilyarevskijS.R., Belenkov Yu.N. i dr. Kakie voprosy` zadayutsya i na kakie voprosy` sposobny` otvetit` issledovaniya po nemedikamentoznomu lecheniyu paczientov s serdechnoj nedostatochnost`yu. Uroki issledovaniya ShANS. Zhurnal Serdechnaya Nedostatochnost`. 2014;15 (6):383–96].
-
Ekman I, Andersson B, Ehnfors M, Matejka G, Persson B, Fagerberg B. Feasibility of a nurse-monitored, outpatient-care programme for elderly patients with moderate-to-severe, chronic heart failure. Eur Heart J. 1998;19 (8):1254–60.
-
Jaarsma T. Effects of education and support on self-care and resource utilization in patients with heart failure. European Heart Journal. 1999;20 (9):673–82. DOI: 10.1053/euhj.1998.1341.
-
Blue L, Lang E, McMurray JJ, Davie AP, McDonagh TA, Murdoch DR etal. Randomised controlled trial of specialist nurse intervention in heart failure. BMJ. 2001;323 (7315):715–8.
-
McDonald K, Ledwidge M, Cahill J, Quigley P, Maurer B, Travers B etal. Heart failure management: Multidisciplinary care has intrinsic benefit above the optimization of medical care. Journal of Cardiac Failure. 2002;8 (3):142–8. DOI: 10.1054/jcaf.2002.124340.
-
Krumholz HM, Amatruda J, Smith GL, Mattera JA, Roumanis SA, Radford MJ etal. Randomized trial of an education and support intervention to prevent readmission of patients with heart failure. JAm Coll Cardiol. 2002;39 (1):83–9.
-
Stewart S, Pearson S, Horowitz JD. Effects of a home-based inter- vention among patients with congestive heart failure discharged from acute hospital care. Arch Intern Med. 1998;158 (10):1067–72.
-
Setoguchi S, Stevenson LW, Schneeweiss S. Repeated hospitaliza- tions predict mortality in the community population with heart fail- ure. American Heart Journal. 2007;154 (2):260–6. DOI: 10.1016/j. ahj.2007.01.041.
-
Maggioni AP, Dahlström U, Filippatos G, Chioncel O, Leiro MC, Drozdz J etal. EURObservational Research Programme: regional differences and 1‑year follow-up results of the Heart Failure Pilot Survey (ESC-HF Pilot). European Journal of Heart Failure. 2013;15 (7):808–17. DOI: 10.1093/eurjhf/hft050.
-
Мареев В.Ю., Арутюнов Г.П., Асташкин Е.И., Вёрткин А.Л., Глезер М.Г., Лопатин Ю.М. и др. Острая декомпенсированная сердечная недостаточность. Согласованная позиция российских экспертов – 2014. Журнал Сердечная Недостаточность. 2014;15 (5):321–36 [Mareev V.Yu., Arutyunov G.P., Astashkin E.I., Vyortkin A.L., Glezer M.G., Lopatin Yu.M. i dr. Ostraya dekompensirovannaya serdechnaya nedostatochnost`. Soglasovannaya pozicziya rossijskix e`kspertov – 2014. Zhurnal Serdechnaya Nedostatochnost`. 2014;15 (5):321–36].
-
Арутюнов А.Г., Драгунов Д.О., Арутюнов Г.П., Рылова А.К., Пашкевич Д.Д., Витер К.В. и др. Первое открытое исследование синдрома острой декомпенсации сердечной недостаточности и сопутствующих заболеваний в Российской Федерации. Независимый регистр ОРАКУЛ–РФ. Кардиология. 2015;55 (5):12–21 [Arutyunov A.G., Dragunov D.O., Arutyunov G.P., Ry`lova A. K., Pashkevich D.D., Viter K.V. i dr. Pervoe otkry`toe issledovanie sindroma ostroj dekompensaczii serdechnoj nedostatochnos- tiisoputstvuyushhixzabolevanijvRossijskojFederaczii.Nezavisimy`j registr ORAKUL–RF. Kardiologiya. 2015;55 (5):12–21].
-
Chakko S, Woska D, Martinez H, de Marchena E, Futterman L, Kessler KM etal. Clinical, radiographic, and hemodynamic correlations in chronic congestive heart failure: conflicting results may lead to inappropriate care. Am J Med. 1991;90 (3):353–9.
-
Wang CS. Does This Dyspneic Patient in the Emergency Department Have Congestive Heart Failure? JAMA. 2005;294 (15):1944. DOI: 10.1001/jama.294.15.1944.
-
Sarasin FP. Acute dyspnea: what is the diagnostic role of B-type natriuretic peptide? Rev Med Suisse. 2005;1 (29):1888–91.
-
Zaphiriou A, Robb S, Murray-Thomas T, Mendez G, Fox K, McDonagh T etal. The diagnostic accuracy of plasma BNP and NTproBNP in patients referred from primary care with suspected heart failure: Results of the UK natriuretic peptide study. European Journal of Heart Failure. 2005;7 (4):537–41. DOI: 10.1016/j. ejheart.2005.01.022.
-
Martindale JL, Wakai A, Collins SP, Levy PD, Diercks D, Hiestand BC etal. Diagnosing Acute Heart Failure in the Emergency Department: A Systematic Review and Meta-analysis. Carpenter C. Academic Emergency Medicine. 2016;23 (3):223–42. DOI: 10.1111/acem.12878.
-
Forrester JS, Diamond GA, Swan HJ. Correlative classification of clinical and hemodynamic function after acute myocardial infarction. Am J Cardiol. 1977;39 (2):137–45.
-
Nohria A, Mielniczuk LM, Warner Stevenson L. Evaluation and Monitoring of Patients with Acute Heart Failure Syndromes. The American Journal of Cardiology. 2005;96 (6):32–40. DOI: 10.1016/j.amjcard.2005.07.019.
-
Park JH, Balmain S, Berry C, Morton JJ, McMurray JJV. Potentially detrimental cardiovascular effects of oxygen in patients with chro nic left ventricular systolic dysfunction. Heart. 2010;96 (7):533–8. DOI: 10.1136/hrt.2009.175257.
-
Rawles JM, Kenmure AC. Controlled trial of oxygen in uncomplicated myocardial infarction. Br Med J. 1976;1 (6018):1121–3.
-
Vital FMR, Ladeira MT, Atallah AN. Non-invasive positive pressure ventilation (CPAP or bilevel NPPV) for cardiogenic pulmonary oedema. Cochrane Database Syst Rev. 2013; (5):CD005351. DOI: 10.1002/14651858. CD005351.pub3.
-
Park M, Sangean MC, Volpe M de S, Feltrim MIZ, Nozawa E, Leite PF etal. Randomized, prospective trial of oxygen, continuous positive airway pressure, and bilevel positive airway pressure by face mask in acute cardiogenic pulmonary edema. Crit Care Med. 2004;32 (12):2407–15.
-
Felker GM, Lee KL, Bull DA, Redfield MM, Stevenson LW, Goldsmith SR etal. Diuretic Strategies in Patients with Acute Decompensated Heart Failure. New England Journal of Medicine. 2011;364 (9):797–805. DOI: 10.1056/NEJMoa1005419.
-
Martens P, Nijst P, Mullens W. Current Approach to Decongestive Therapy in Acute Heart Failure. Current Heart Failure Reports. 2015;12 (6):367–78. DOI: 10.1007/s11897‑015‑0273‑5.
-
van Vliet A,DonkerAJM,NautaJJP,VerheugtFWA.Spironolactone in congestive heart failure refractory to high-dose loop diuretic and low-dose angiotensin-converting enzyme inhibitor. The American Journal of Cardiology. 1993;71 (3):A21–8. DOI: 10.1016/0002– 9149 (93) 90241–4.
-
Butler J, Hernandez AF, Anstrom KJ, Kalogeropoulos A, Redfield MM, Konstam MA etal. Rationale and Design of the ATHENA-HF Trial. JACC: Heart Failure. 2016;4 (9):726–35. DOI: 10.1016/j. jchf.2016.06.003.
-
Knauf H, Mutschler E. Sequential nephron blockade breaks resis- tance to diuretics in edematous states. J Cardiovasc Pharmacol. 1997;29 (3):367–72.
-
Bart BA, Goldsmith SR, Lee KL, Givertz MM, O’Connor CM, Bull DA etal. Ultrafiltration in Decompensated Heart Failure with Cardiorenal Syndrome. New England Journal of Medicine. 2012;367 (24):2296–304. DOI: 10.1056/NEJMoa1210357.
-
Farag M, Shoaib A, Gorog DA. Nitrates for the Management of Acute Heart Failure Syndromes, A Systematic Review. Journal of Cardiovascular Pharmacology and Therapeutics. 2017;22 (1):20–7. DOI: 10.1177/1074248416644345.
-
Wakai A, McCabe A, Kidney R, Brooks SC, Seupaul RA, Diercks DB etal. Nitrates for acute heart failure syndromes. Cochrane Database of Systematic Reviews. 2013;6 (8):CD005151. DOI: 10.1002/14651858. CD005151.pub2.
-
Cotter G, Metzkor E, Kaluski E, Faigenberg Z, Miller R, Simovitz A etal. Randomised trial of high-dose isosorbide dinitrate plus lowdose furosemide versus high-dose furosemide plus low-dose isosorbide dinitrate in severe pulmonary oedema. The Lancet. 1998;351 (9100):389–93. DOI: 10.1016/S0140–6736 (97) 08417–1.
-
Teerlink JR, Cotter G, Davison BA, Felker GM, Filippatos G, Greenberg BH etal. Serelaxin, recombinant human relaxin-2, for treatment of acute heart failure (RELAX-AHF): a randomised, placebo-controlled trial. The Lancet. 2013;381 (9860):29–39. DOI: 10.1016/S0140–6736 (12) 61855–8.
-
Belletti A, Castro ML, Silvetti S, Greco T, Biondi-Zoccai G, Pasin L etal. The Effect of inotropes and vasopressors on mortality: a meta- analysis of randomized clinical trials. Myles PS. British Journal ofAnaesthesia. 2015;115 (5):656–75. DOI: 10.1093/bja/aev284.
-
Elkayam U, Tasissa G, Binanay C, Stevenson LW, Gheorghiade M, Warnica JW etal. Use and impact of inotropes and vasodilator therapy in hospitalized patients with severe heart failure. American Heart Journal. 2007;153 (1):98–104. DOI: 10.1016/j.ahj.2006.09.005.
-
Mebazaa A, Parissis J, Porcher R, Gayat E, Nikolaou M, Boas FV etal. Short-term survival by treatment among patients hospita lized with acute heart failure: the global ALARM-HF registry using propensity scoring methods. Intensive Care Medicine. 2011;37 (2):290–301. DOI: 10.1007/s00134‑010‑2073‑4.
-
Kivikko M, Pollesello P, Tarvasmäki T, Sarapohja T, Nieminen MS, Harjola V-P. Effect of baseline characteristics on mortality in the SURVIVE trial on the effect of levosimendan vs dobutamine in acute heart failure: Sub-analysis of the Finnish patients. International Journal of Cardiology. 2016;215:26–31. DOI: 10.1016/j.ijcard.2016.04.064.
-
The Consensus Trial Study Group*. Effects of Enalapril on Mortality in Severe Congestive Heart Failure. New England Journal of Medicine. 1987;316 (23):1429–35. DOI: 10.1056/NE JM198706043162301.
-
Jondeau G, Neuder Y, Eicher J-C, Jourdain P, Fauveau E, Galinier M etal. B-CONVINCED: Beta-blocker CONtinuation Vs. INterrup tion in patients with Congestive heart failure hospitalizED for a decompensation episode. European Heart Journal. 2009;30 (18):2186–92. DOI: 10.1093/eurheartj/ehp323
-
Packer M, Fowler MB, Roecker EB, Coats AJS, Katus HA, Krum H etal. Effect of carvedilol on the morbidity of patients with severe chronic heart failure: results of the carvedilol prospective rando mized cumulative survival (COPERNICUS) study. Circulation. 2002;106 (17):2194–9.
-
The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a ran- domised trial. Lancet. 1999;353 (9146):9–13.
-
Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999;353 (9169):2001–7.
-
Borer JS, Bohm M, Ford I, Komajda M, Tavazzi L, Sendon JL etal. Effect of ivabradine on recurrent hospitalization for worse ning heart failure in patients with chronic systolic heart failure: the SHIFT Study. European Heart Journal. 2012;33 (22):2813–20. DOI: 10.1093/eurheartj/ehs259.
-
Heywood JT, Fonarow GC, Costanzo MR, Mathur VS, Wigneswaran JR, Wynne J. High Prevalence of Renal Dysfunction and Its Impact on Outcome in 118,465 Patients Hospitalized With Acute Decompensated Heart Failure: A Report From the ADHERE Database. Journal of Cardiac Failure. 2007;13 (6):422–30. DOI: 10.1016/j.cardfail.2007.03.011.
-
Campbell RC, Sui X, Filippatos G, Love TE, Wahle C, Sanders PW etal. Association of chronic kidney disease with outcomes in chro nic heart failure: a propensity-matched study. Nephrology Dialysis Transplantation. 2008;24 (1):186–93. DOI: 10.1093/ndt/gfn445.
-
Hillege HL. Renal Function as a Predictor of Outcome in a Broad Spectrum of Patients With Heart Failure. Circulation. 2006;113 (5):671–8. DOI: 10.1161/CIRCULATIONAHA.105.580506.
-
Gigante A, Liberatori M, Gasperini ML, Sardo L, Di Mario F, Dorelli B etal. Prevalence and Clinical Features of Patients with the Cardiorenal Syndrome Admitted to an Intern al Medicine Ward. Cardiorenal Medicine. 2014;4 (2):88–94. DOI: 10.1159/000362566.
-
Clementi A, Virzì GM, Goh CY, Cruz DN, Granata A, Vescovo G etal. Cardiorenal Syndrome Type 4: A Review. Cardiorenal Medicine. 2013;3 (1):63–70. DOI: 10.1159/000350397.
-
Damman K, Valente MAE, Voors AA, O’Connor CM, van Veldhuisen DJ, Hillege HL. Renal impairment, worsening renal function, and outcome in patients with heart failure: an updated meta-analysis. European Heart Journal. 2014;35 (7):455–69. DOI: 10.1093/eurheartj/eht386.
-
Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney inter. 2012; (2):1–138.
-
AdamsKF,FonarowGC,EmermanCL,LeJemtelTH,CostanzoMR, Abraham WT etal. Characteristics and outcomes of patients hospitalized for heart failure in the United States: Rationale, design, and preliminary observations from the first 100,000 cases in the Acute Decompensated Heart Failure National Registry (ADHERE). American Heart Journal. 2005;149 (2):209–16. DOI: 10.1016/j. ahj.2004.08.005.
-
FonarowGC,StoughWG,AbrahamWT,AlbertNM,Gheorghiade M, Greenberg BH etal. Characteristics, Treatments, and Outcomes of Patients With Preserved Systolic Function Hospitalized for Heart Failure. Journal of the American College of Cardiology. 2007;50 (8):768–77. DOI: 10.1016/j.jacc.2007.04.064.
-
Effect of intensive blood-glucose control with metformin on com- plications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group. Lancet. 1998;352 (9131):854–65.
-
Masoudi FA. Thiazolidinediones, Metformin, and Outcomes inOlderPatientsWithDiabetesandHeartFailure: AnObservational Study. Circulation. 2005;111 (5):583–90. DOI: 10.1161/01. CIR.0000154542.13412. B1.
-
Lincoff AM, Wolski K, Nicholls SJ, Nissen SE. Pioglitazone and Risk of Cardiovascular Events in Patients With Type 2 Diabetes Mellitus: A Meta-analysis of Randomized Trials. JAMA. 2007;298 (10):1180. DOI: 10.1001/jama.298.10.1180.
-
SciricaBM,BhattDL,BraunwaldE,StegPG,DavidsonJ,HirshbergB etal. Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus. New England Journal of Medicine. 2013;369 (14):1317–26. DOI: 10.1056/NEJMoa1307684.
-
White WB, Cannon CP, Heller SR, Nissen SE, Bergenstal RM, Bakris GL etal. Alogliptin after Acute Coronary Syndrome in Patients with Type 2 Diabetes. New England Journal of Medicine. 2013;369 (14):1327–35. DOI: 10.1056/NEJMoa1305889.
-
Green JB, Bethel MA, Armstrong PW, Buse JB, Engel SS, Garg J etal. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. New England Journal of Medicine. 2015;373 (3):232–42. DOI: 10.1056/NEJMoa1501352.
-
Pfeffer MA, Claggett B, Diaz R, Dickstein K, Gerstein HC, Køber LV etal. Lixisenatide in Patients with Type 2 Diabetes and Acute Coronary Syndrome. New England Journal of Medicine. 2015;373 (23):2247–57. DOI: 10.1056/NEJMoa1509225.
-
Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA etal. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. New England Journal of Medicine. 2016;375 (19):1834–44. DOI: 10.1056/NEJMoa1607141.
-
Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S etal. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. New England Journal of Medicine. 2015;373 (22):2117–28. DOI: 10.1056/NEJMoa1504720.
-
Sonesson C, Johansson PA, Johnsson E, Gause-Nilsson I. Cardio vascular effects of dapagliflozin in patients with type 2 diabetes and different risk categories: a meta-analysis. Cardiovascular Diabetology. 2016;15 (1). DOI: 10.1186/s12933‑016‑0356‑y.
-
Authors/Task Force Members, Dickstein K, Cohen-Solal A, Filippatos G, McMurray JJV, Ponikowski P etal. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM). European Heart Journal. 2008;29 (19):2388–442. DOI: 10.1093/eurheartj/ehn309.
-
Barzilay J. Risk and impact of incident glucose disorders in hyper- tensive older adults treated with an ace inhibitor, a diuretic, or a calcium channel blocker: a report from the allhat trial. American Journal of Hypertension. 2004;17 (5):S1. DOI: 10.1016/j.amjhyper.2004.03.002.
-
Gottlieb SS, McCarter RJ, Vogel RA. Effect of Beta-Blockade on Mortality among High-Risk and Low-Risk Patients after Myocardial Infarction. New England Journal of Medicine. 1998;339 (8):489–97. DOI: 10.1056/NEJM199808203390801.
-
Heinemann L, Heise T, Ampudia J, Sawicki P, Sindelka G, Brunner G etal. Four week administration of an ACE inhibitor and a cardioselective beta-blocker in healthy volunteers: no influence on insulin sensitivity. Eur J Clin Invest. 1995;25 (8):595–600.
-
Giugliano D, Acampora R, Marfella R, De Rosa N, Ziccardi P, Ragone R etal. Metabolic and cardiovascular effects of carvedilol and atenolol in non-insulin-dependent diabetes mellitus and hypertension. A randomized, controlled trial. Ann Intern Med. 1997;126 (12):955–9.
-
Мареев В.Ю., Даниелян М.О., Осмаловская Ю.Ф., Агеев Ф.Т., Серединина Е.М., Жубрина Е.С. и др. НЕбиволол против МЕтопролола: сравнительное рандомиЗированное ИсслеДо вАние у больных Хронической Сердечной Недостаточностью (НЕМЕЗИДА–ХСН). Журнал Сердечная Недостаточность. 14 (2):63–74 [Mareev V.Yu., Danielyan M.O., Osmalovskaya Yu.F., Ageev F.T., Seredinina E.M., Zhubrina E.S. i dr. NEbivolol protiv MEtoprolola: sravnitel`noe randomiZirovannoe IssleDovAnie u bol`ny`x Xronicheskoj Serdechnoj Nedostatochnost`yu (NEMEZIDA–XSN). Zhurnal Serdechnaya Nedostatochnost`. 14 (2):63–74].
-
Torp-Pedersen C, Metra M, Charlesworth A, Spark P, Lukas MA, Poole-Wilson PA etal. Effects of metoprolol and carvedilol on pre-existing and new onset diabetes in patients with chronic heart failure: data from the Carvedilol Or Metoprolol European Trial (COMET). Heart. 2007;93 (8):968–73. DOI: 10.1136/hrt.2006.092379.
-
Bakris GL, Fonseca V, Katholi RE, McGill JB, Messerli FH, Phillips RA etal. Metabolic Effects of Carvedilol vs Metoprolol in Patients With Type 2 Diabetes Mellitus and Hypertension: A Randomized Controlled Trial. JAMA. 2004;292 (18):2227. DOI: 10.1001/jama.292.18.2227.
-
Hawkins NM, Huang Z, Pieper KS, Solomon SD, Kober L, Velazquez EJ etal. Chronic obstructive pulmonary disease is an independent predictor of death but not atherosclerotic events in patients with myocardial infarction: analysis of the Valsartan in Acute Myocardial Infarction Trial (VALIANT). European Journal of Heart Failure. 2009;11 (3):292–8. DOI: 10.1093/eurjhf/hfp001.
-
Apostolovic S, Jankovic-Tomasevic R, Salinger-Martinovic S, Djordjevic-Radojkovic D, Stanojevic D, Pavlovic M etal. Frequency and significance of unrecognized chronic obstructive pulmonary disease in elderly patients with stable heart failure. Aging Clinical and Experimental Research. 2011; (5–6). DOI: 10.3275/7291.
-
Mentz RJ, Schulte PJ, Fleg JL, Fiuzat M, Kraus WE, Piña IL etal. Clinical characteristics, response to exercise training, and outcomes in patients with heart failure and chronic obstructive pulmonary disease: Findings from Heart Failure and A Controlled Trial Investigating Outcomes of Exercise TraiNing (HF-ACTION). American Heart Journal. 2013;165 (2):193–9. DOI: 10.1016/j. ahj.2012.10.029.
-
Le Jemtel TH, Padeletti M, Jelic S. Diagnostic and Therapeutic Challenges in Patients With Coexistent Chronic Obstructive Pulmonary Disease and Chronic Heart Failure. Journal of the American College of Cardiology. 2007;49 (2):171–80. DOI: 10.1016/j.jacc.2006.08.046.
-
Zeng Q, Jiang S. Update in diagnosis and therapy of coexistent chronic obstructive pulmonary disease and chronic heart fai lure. J Thorac Dis. 2012;4 (3):310–5. DOI: 10.3978/j.issn.2072– 1439.2012.01.09.
-
Чучалин А.Г. Хроническая обструктивная болезнь легких и сопутствующие заболевания. Терапевтический архив. 2013;85 (8):43–8 [Chuchalin A.G. Xronicheskaya obstruktivnaya bolezn` legkix i soputstvuyushhie zabolevaniya. Terapevticheskij arxiv. 2013;85 (8):43–8].
-
Mancini GBJ, Etminan M, Zhang B, Levesque LE, FitzGerald JM, Brophy JM. Reduction of Morbidity and Mortality by Statins, Angiotensin-Converting Enzyme Inhibitors, and Angiotensin Receptor Blockers in Patients With Chronic Obstructive Pulmonary Disease. Journal of the American College of Cardiology. 2006;47 (12):2554–60. DOI: 10.1016/j.jacc.2006.04.039.
-
Mortensen EM, Copeland LA, Pugh MJV, Restrepo MI, de Molina RM, Nakashima B etal. Impact of statins and ACE inhibitors on mortality after COPD exacerbations. Respiratory Research. 2009;10 (1). DOI: 10.1186/1465‑9921‑10‑45.
-
Федотов П.А., Ситникова М.Ю., Сафьянова Н.В., Шапорова Н.Л. Хроническая сердечная недостаточность ишемического генеза и хроническая обструктивная болезнь легких: возможности комбинированной терапии, включающей небиволол. Клиницист. 2013; (3–4):40–7 [Fedotov P.A., Sitnikova M.Yu., Saf`yanova N. V., Shaporova N.L. Xronicheskaya serdechnaya nedostatochnost` ishemicheskogo geneza i xronicheskaya obstruktivnaya bolezn` legkix: vozmozhnosti kombinirovannoj terapii, vklyuchayushhej nebivolol. Kliniczist. 2013; (3–4):40–7].
-
Stefan MS, Rothberg MB, Priya A, Pekow PS, Au DH, Lindenauer PK. Association between β-blocker therapy and outcomes in patients hospitalised with acute exacerbations of chronic obstructive lung disease with underlying ischaemic heart disease, heart failure or hypertension. Thorax. 2012;67 (11):977–84. DOI: 10.1136/thoraxjnl-2012–201945.
-
Etminan M, Jafari S, Carleton B, FitzGerald JM. Betablocker use and COPD mortality: a systematic review and meta-analysis. BMC Pulmonary Medicine. 2012;12 (1). DOI: 10.1186/1471‑2466‑12‑48.
-
Rutten FH. β-Blockers May Reduce Mortality and Risk of Exacer bations in Patients With Chronic Obstructive Pulmonary Disease. Archives of Internal Medicine. 2010;170 (10):880–7. DOI: 10.1001/archinternmed.2010.112.
-
Du Q, Sun Y, Ding N, Lu L, Chen Y. Beta-Blockers Reduced the Risk of Mortality and Exacerbation in Patients with COPD: A Meta-Analysis of Observational Studies. Chalmers JD. PLoS ONE. 2014;9 (11):e113048. DOI: 10.1371/journal.pone.0113048.
-
Rutledge T, Reis VA, Linke SE, Greenberg BH, Mills PJ. Depression in Heart Failure. Journal of the American College of Cardiology. 2006;48 (8):1527–37. DOI: 10.1016/j.jacc.2006.06.055.
-
Оганов Р.Г., Ольбинская Л.И., Смулевич А.Б., Вейн А.М., Дробижев М.Ю., Шальнова С.А. и др. Депрессии и расстройства депрессивного спектра в общемедицинской практике. Результаты программы КОМПАС. Кардиология. 2004;44 (1):48 [Oganov R.G., Ol`binskaya L. I., Smulevich A.B., Vejn A.M., Drobizhev M.Yu., Shal`nova S. A. idr. Depressii i rasstrojstva depressivnogo spektra v obshhemediczinskoj praktike. Rezul`taty` programmy` KOMPAS. Kardiologiya. 2004;44 (1):48].
-
Беграмбекова Ю.Л., Дробижев М.Ю., Мареев В.Ю., Кикта С.В. Можно ли сказать что‑то новое о депрессиях у больных хронической сердечной недостаточностью? Журнал Сердечная Недостаточность. 2015;16 (6):360–7. DOI: 10.180 87/rhfj.2015.6.2161 [Begrambekova Yu. L., Drobizhev M. Yu., Mareev V.Yu., Kikta S.V. Mozhno li skazat` chto-to novoe o depressiyax u bol`ny`x xronicheskoj serdechnoj nedostatochnost`yu? Zhurnal Serdechnaya Nedostatochnost`. 2015;16 (6):360–7. DOI :10.18087/rhfj.2015.6.2161].
-
Васюк Ю.А., Довженко Т.В. Хроническая сердечная недостаточность и расстройства депрессивного спектра. Журнал Сердечная Недостаточность. 2009;10 (6):342–8 [Vasyuk Yu.A., Dovzhenko T.V. Xronicheskaya serdechnaya nedostatochnost` i rasstrojstva depressivnogo spektra. Zhurnal Serdechnaya Nedostatochnost`. 2009;10 (6):342–8].
-
Pihl E, Jacobsson A, Fridlund B, Strömberg A, Måtensson J. Depression and health-related quality of life in elderly patients suffering from heart failure and their spouses: a comparative study. European Journal of Heart Failure. 2005;7 (4):583–9. DOI: 10.1016/j.ejheart.2004.07.016.
-
Sullivan M, Simon G, Spertus J, Russo J. Depression-related costs in heart failure care. Arch Intern Med. 2002;162 (16):1860–6.
-
Katon W, Lin EHB, Kroenke K. The association of depression and anxiety with medical symptom burden in patients with chronic medical illness. General Hospital Psychiatry. 2007;29 (2):147–55. DOI: 10.1016/j.genhosppsych.2006.11.005.
-
Дробижев М.Ю., Беграмбекова Ю.Л., Мареев В.Ю., Кикта С.В. Влияние депрессии и тревоги на клинические исходы у больных ХСН. Журнал Сердечная Недостаточность. 2016;17 (2):91–8. DOI: 10.18087/rhfj.2016.2.2206 [Drobizhev M. Yu., Begrambekova Yu.L., Mareev V.Yu., Kikta S.V. Vliyanie depressii i trevogi na klinicheskie isxody` u bol`ny`x XSN. Zhurnal SerdechnayaNedostatochnost`.2016;17(2):91–8.DOI: 10.18087/ rhfj.2016.2.2206].
-
DiMatteo MR, Lepper HS, Croghan TW. Depression is a risk factor for noncompliance with medical treatment: meta-analysis of the effects of anxiety and depression on patient adherence. Arch Intern Med. 2000;160 (14):2101–7.
-
Lahlou-Laforêt K, Ledru F, Niarra R, Consoli SM. Validity of Beck Depression Inventory for the assessment of depressive mood in chronic heart failure patients. Journal of Affective Disorders. 2015;184:256–60. DOI: 10.1016/j.jad.2015.05.056.
-
Bjelland I, Dahl AA, Haug TT, Neckelmann D. The validity of the Hospital Anxiety and Depression Scale. An updated literature review. J Psychosom Res. 2002;52 (2):69–77.
-
Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand. 1983;67 (6):361–70.
-
Андрющенко А.В., Дробижев М.Ю., Добровольский А.В. Сравнительная оценка шкал CES-D, BDI и HADS (d) в диагностике депрессий в общемедицинской практике. Журнал неврологии и психиатрии им СС Корсакова. 2003; (5):11–8 [Andryushhenko A.V., Drobizhev M.Yu., Dobrovol`skij A.V. Sravnitel`naya oczenka shkal CES-D, BDI i HADS (d) v diagnostike depressij v obshhemediczinskoj praktike. Zhurnal nevrologii i psixiatrii im SS Korsakova. 2003; (5):11–8].
-
Gelbrich G, Störk S, Kreißl-Kemmer S, Faller H, Prettin C, Heuschmann PU etal. Effects of structured heart failure disease management on mortality and morbidity depend on patients’ mood: results from the Interdisciplinary Network for Heart Failure Study: Effects of structured HF management depend on patients’ mood. European Journal of Heart Failure. 2014;16 (10):1133–41. DOI:10.1002/ejhf.150.
-
de la Porte PWFB-A, Lok DJA, van Veldhuisen DJ, van Wijngaarden J, Cornel JH, Zuithoff NPA etal. Added value of a physician-and-nurse-directed heart failure clinic: results from the Deventer – Alkmaar heart failure study. Heart. 2007;93 (7):819–25. DOI: 10.1136/hrt.2006.095810.
-
Clark AM, Thompson DR. The future of management programmes for heart failure. The Lancet. 2008;372 (9641):784–6. DOI:10.1016/S0140–6736 (08) 61317–3.
-
Беленков Ю.Н., Агеев Ф.Т., Банщиков Г.Т., Волкова Е.Г., Гиляревский С.Р., Донова И.Г. и др. Влияние специализированных форм активного амбулаторного ведения на функциональный статус, качество жизни и показатели гемодинамики больных с выраженной сердечной недостаточностью. Результаты Российской программы «ШАНС». Журнал Сердечная Недостаточность. 2007;8 (3):112–6 [Belenkov Yu.N., Ageev F.T., Banshhikov G.T., Volkova E.G., Gilyarevskij S.R., Donova I.G. i dr. Vliyanie speczializirovanny`x form aktivnogo ambulatornogo vedeniya na funkczional`ny`j status, kachestvo zhizni i pokazateli gemodinamiki bol`ny`x s vy`razhennoj ser- dechnoj nedostatochnost`yu. Rezul`taty` Rossijskoj programmy` «ShANS». Zhurnal Serdechnaya Nedostatochnost`. 2007;8 (3):112–6].
-
Беграмбекова Ю.Л., Мареев В.Ю., Дробижев М.Ю. Школы для пациентов с сердечной недостаточностью. Есть ли ШАНС повлиять на депрессию и тревогу? Вторичный (Posthoc) анализ исследования ШАНС (Школа и Амбулаторное Наблюдение больных Сердечной недостаточностью). Журнал Сердечная Недостаточность. 2016;17 (6):433–42. DOI: 10.18087/rhfj.2016.6.2281 [BegrambekovaYu. L., MareevV. Yu., Drobizhev M.Yu. Shkoly` dlya paczientov s serdechnoj nedostatochnost`yu. Est` li ShANS povliyat` na depressiyu i trevogu? Vtorichny`j (Post-hoc) analiz issledovaniya ShANS (Shkola i Ambulatornoe Nablyudenie bol`ny`x Serdechnoj nedostatochnost`yu). Zhurnal Serdechnaya Nedostatochnost`. 2016;17 (6):433–42. DOI: 10.18087/rhfj.2016.6.2281].
-
Dekker RL. Cognitive Therapy for Depression in Patients with Heart Failure: A Critical Review. Heart Failure Clinics. 2011;7 (1):127–41. DOI: 10.1016/j.hfc.2010.10.001.
-
Tu R-H, Zeng Z-Y, Zhong G-Q, Wu W-F, Lu Y-J, Bo Z-D etal. Effects of exercise training on depression in patients with heart failure: a systematic review and meta-analysis of randomized controlled trials: Effects of exercise training on depression in HF: a systematic review. European Journal of Heart Failure. 2014;16 (7):749–57. DOI: 10.1002/ejhf.101.
-
Blumenthal JA, Babyak MA, O’Connor C, Keteyian S, Landzberg J, Howlett J etal. Effects of Exercise Training on Depressive Symptoms in Patients With Chronic Heart Failure: The HF-ACTION Randomized Trial. JAMA. 2012;308 (5):465– 74. DOI: 10.1001/jama.2012.8720.
-
Glassman AH. Cardiovascular Effects of Tricyclic Antidepressants. Annual Review of Medicine. 1984;35 (1):503–11. DOI: 10.1146/ annurev.me.35.020184.002443.
-
O’Connor CM, Jiang W, Kuchibhatla M, Silva SG, Cuffe MS, Callwood DD etal. Safety and Efficacy of Sertraline for Depression in Patients With Heart Failure. Journal of the American College of Cardiology. 2010;56 (9):692–9. DOI: 10.1016/j. jacc.2010.03.068.
-
Angermann CE, Gelbrich G, Störk S, Gunold H, Edelmann F, Wachter R etal. Effect of Escitalopram on All-Cause Mortality and Hospitalization in Patients With Heart Failure and Depression: The MOOD-HF Randomized Clinical Trial. JAMA. 2016;315 (24):2683. DOI: 10.1001/jama.2016.7635.
-
Faller H, Störk S, Gelbrich G, Schowalter M, Ertl G, Angermann CE. Depressivesymptomsinheartfailure: Independentprognosticfactor or marker of functional status? Journal of Psychosomatic Research. 2015;78 (6):569–72. DOI: 10.1016/j.jpsychores.2015.02.015.
-
Goldberg RJ, Capone RJ, Hunt JD. Cardiac complications follo wing tricyclic antidepressant overdose. Issues for monitoring policy. JAMA. 1985;254 (13):1772–5.
-
Pacher P, Ungvari Z, Nanasi PP, Furst S, Kecskemeti V. Speculations on difference between tricyclic and selective serotonin reuptake inhibitor antidepressants on their cardiac effects. Is there any? Curr Med Chem. 1999;6 (6):469–80.
-
Burris KD, Molski TF, Xu C, Ryan E, Tottori K, Kikuchi T etal. Aripiprazole, a novel antipsychotic, is a high-affinity partial agonist at human dopamine D2 receptors. J Pharmacol Exp Ther. 2002;302 (1):381–9.
-
Jordan S, Koprivica V, Chen R, Tottori K, Kikuchi T, Altar CA. The antipsychotic aripiprazole is a potent, partial agonist at the human 5‑HT1A receptor. Eur J Pharmacol. 2002;441 (3):137–40.
-
Taylor DM. Aripiprazole: a review of its pharmacology and clinical use. Int J Clin Pract. 2003;57 (1):49–54.
Материал поступил в редакцию 26/01/2017